题目内容
(27分)(1)现有如下两个反应:①NaOH + HCl =" NaCl" + H2O;②Fe +H2SO4 = FeSO4 + H2 ↑
两反应中为放热反应的是 ,能设计成原电池的是 。(填序号)
(2)根据下图填空①电子从 片流出,溶液中H+向 片移动。

② 正极的现象是 ,发生 反应(填写“氧化”或“还原”)。
③负极的电极方程式为
④ 若反应过程中有0.01mol电子发生转移,则生成的氢气在标准状况下的体积为 L。
(3)写出电解氯化铜溶液时,阴极的电极反应方程式: 。
两反应中为放热反应的是 ,能设计成原电池的是 。(填序号)
(2)根据下图填空①电子从 片流出,溶液中H+向 片移动。

② 正极的现象是 ,发生 反应(填写“氧化”或“还原”)。
③负极的电极方程式为
④ 若反应过程中有0.01mol电子发生转移,则生成的氢气在标准状况下的体积为 L。
(3)写出电解氯化铜溶液时,阴极的电极反应方程式: 。
(1)①②; ②
(2) ①Zn ; Cu; ②有气泡产生; 还原; ③Zn—2e—==Zn2+; ④0.112
(3)Cu2++2e—= Cu
(2) ①Zn ; Cu; ②有气泡产生; 还原; ③Zn—2e—==Zn2+; ④0.112
(3)Cu2++2e—= Cu
试题分析:(1)①是酸碱中和反应,是放热反应;②是置换反应,属于放热反应;能设计成原电池的反应应该是有电子转移的氧化还原反应,②有化合价的升降,是氧化还原反应,可以设计为原电池。(2)① 在该原电池中Zn为负极,失去电子,电子从Zn片流出。经过导线,流回正极Cu。在溶液中根据同种电荷相互排斥,异种电荷相互吸引的原则,H+向含有负电荷较多的正极Cu片移动。② 在正极Cu上发生反应:2H++2e-=H2↑,反应类型是还原反应,看到的现象是有气泡产生。③在负极上Zn失去电子,被氧化。负极的电极方程式为Zn—2e—==Zn2+;④ 若反应过程中有0.01mol电子发生转移,根据电子守恒,可得n(H2)=0.005mol,所以生成的氢气在标准状况下的体积为0.005mol×22.4L/mol=0.112L.(3)电解氯化铜溶液时,在阴极上Cu2+得到电子,发生还原反应。该电极反应方程式:Cu2++2e—= Cu。

练习册系列答案
相关题目

 则反应2SO2(g)+O2(g) 2SO3(g)的△H= kJ·mol-l。使用V2O5作催化剂后该反应逆反应的活化能 (填“增大”、“不变”或“减小”)。
则反应2SO2(g)+O2(g) 2SO3(g)的△H= kJ·mol-l。使用V2O5作催化剂后该反应逆反应的活化能 (填“增大”、“不变”或“减小”)。



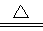 LiNH2+2LiH,氧化产物为 (填化学式)。在270℃时,该反应可逆向发生放出H2,因而氮化锂可作为储氢材料,储存氢气最多可达Li3N质量的 %(精确到0.1)。
LiNH2+2LiH,氧化产物为 (填化学式)。在270℃时,该反应可逆向发生放出H2,因而氮化锂可作为储氢材料,储存氢气最多可达Li3N质量的 %(精确到0.1)。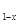 FePO4之间的转化,电池放电时负极发生的反应为LiXC6-Xe—
FePO4之间的转化,电池放电时负极发生的反应为LiXC6-Xe—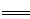 XLi++6C,写出电池放电时的电极反应的化学方程式 。
XLi++6C,写出电池放电时的电极反应的化学方程式 。