题目内容
【题目】利用湿法炼锌产生的铜镉渣生产金属镉的流程如下:

已知:铜镉渣主要含锌、铜、铁、镉(Cd)、钴(Co)等单质。
下表列出了相关金属离子生成氢氧化物沉淀的pH(开始沉淀的pH按金属离子浓度为0.1 mol·L-1计算):
氢氧化物 | Fe(OH)3 | Fe(OH)2 | Cd(OH)2 | Mn(OH)2 |
开始沉淀的pH | 1.5 | 6.5 | 7.2 | 8.2 |
沉淀完全的pH | 3.3 | 9.9 | 9.5 | 10.6 |
(1)为了提高铜镉渣浸出的速率,可采取的措施有:①适当升高温度;②搅拌;③______等。已知浸出的金属离子均为二价,写出浸出钴的化学方程式__________________。
(2)除钴的过程中,需要加入活化剂Sb2O3,锌粉会与Sb2O3、Co2+的溶液形成微电池并产生合金CoSb。该微电池的正极反应式为________________________________。
(3)除铁的过程分两步进行:
①先加入适量KMnO4,发生反应的离子方程式为______________________________,
②再加入ZnO控制反应液的pH范围为_____________。
(4)除铁过程第①步,若加入KMnO4时条件控制不当,MnO2会继续反应,造成的结果是______________,若加入的KMnO4不足量,则待电解溶液中有Fe元素残余。请设计实验方案加以验证_________________。
(5)净化后的溶液用惰性电极电解可获得镉单质。电解废液中可循环利用的溶质是____。
(6)处理含镉废水常用化学沉淀法,以下是几种镉的难溶化合物的溶度积常数(25℃):
Ksp(CdCO3)=5.210-12, Ksp(CdS)=3.610-29,Ksp(Cd(OH)2)=2.010-16,根据上述信息:
沉淀Cd2+效果最佳的试剂是____________。
a.Na2CO3 b.Na2S c.CaO
若采用生石灰处理含镉废水最佳pH为11,此时溶液中c(Cd2+)=_________。
【答案】 增大硫酸的浓度(或经铜镉渣研成粉末) Co+H2SO4=== CoSO4+H2↑ Sb2O3+2Co2++6H++10e-===2CoSb+3H2O 3Fe2++MnO+4H+===3Fe3++MnO2+2H2O 3.3~7.2 还原产物Mn2+,进入电解液中,引入杂质 取样,向其中滴加H2O2后再滴入KSCN溶液,若溶液变红(或向其中滴加K3[Fe(CN)6]溶液,若产生蓝色沉淀),则待电解液中含有Fe元素 H2SO4(或硫酸) b 2.010-10mol/L
【解析】本题分析:本题主要考查溶液中的离子反应。
(1)为了提高铜镉渣浸出的速率,可采取的措施有:①适当升高温度;②搅拌;③增大硫酸的浓度(或将铜镉渣研成粉末)等。浸出钴的化学方程式为Co+H2SO4=CoSO4+H2↑。
(2)该微电池的正极反应式为Sb2O3+2Co2++6H++10e-=2CoSb+3H2O。
(3)除铁的过程分两步进行,①加入适量KMnO4,将Fe2+氧化为Fe3+ ,发生反应的离子方程式为3Fe2++MnO4-+4H+=3Fe3++MnO2+2H2O,②加入ZnO提高pH,将Fe3+转化为Fe(OH)3过滤除去,同时不能损失Cd2+,所以控制反应液的pH范围为3.3-7.2。
(4)若加入KMnO4时条件控制不当,MnO2会继续反应,造成的结果是还原产物Mn2+进入电解液中,引入杂质,若加入的KMnO4不足量,则待电解溶液中有Fe元残余。验证方法:取样,向其中滴加H2O2后再滴入KSCN溶液,若溶液变红,则待电解液中含有Fe元素。
(5)阳极产生硫酸,所以电解废液中可循环利用的溶质是硫酸。
(6)因为Ksp(CdS)最小,所以沉淀Cd2+效果最佳的试剂是b。
c(OH-)=![]() =
=![]() mol/L=1×10-3mol/L,c(Cd2+)=
mol/L=1×10-3mol/L,c(Cd2+)=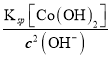 =2.0×10-10mol/L。
=2.0×10-10mol/L。

 学练快车道快乐假期暑假作业新疆人民出版社系列答案
学练快车道快乐假期暑假作业新疆人民出版社系列答案 浙大优学小学年级衔接导与练浙江大学出版社系列答案
浙大优学小学年级衔接导与练浙江大学出版社系列答案 小学暑假作业东南大学出版社系列答案
小学暑假作业东南大学出版社系列答案 津桥教育暑假拔高衔接广东人民出版社系列答案
津桥教育暑假拔高衔接广东人民出版社系列答案 波波熊暑假作业江西人民出版社系列答案
波波熊暑假作业江西人民出版社系列答案