题目内容
【题目】某反应体系的物质有:NaOH、Au2O3、Na2S4O6、Na2S2O3、Au2O、H2O。
(1)请将Au2O3之外反应物与生成物分别填入以下空格内。
![]()
(2)反应中,被还原的元素是____________,还原剂是____________。
(3)将氧化剂与还原剂填入空格中,并标出电子转移的方向和数目。
![]()
(4)纺织工业中常用氯气作漂白剂,Na2S2O3可作为漂白后布匹“脱氯剂”,Na2S2O3和Cl2反应的产物是H2SO4、NaCl和HCl,则还原剂与氧化剂物质的量之比为__________。
【答案】
(1)Na2S2O3;H2O;Au2O;Na2S4O6;NaOH;
(2)+3价的Au元素;Na2S2O3;
(3)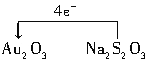 ;(4)1:4
;(4)1:4
【解析】
试题分析:(1)Au2O3为反应物,则反应中Au2O3→Au2O,Au的化合价由+3价变为+1价,则Au元素被还原,Na2S4O6中硫元素平均化合价为+2.5,Na2S2O3中硫元素平均化合价为+2,所以Na2S2O3为反应物,Na2S4O6为生成物,即氧化产物,由于2Na2S2O3→1Na2S4O6,S硫元素平均化合价由+2价升高为+2.5价,化合价总共升高8×(2.5-2)=4,根据化合价升降相等,反应方程式为Au2O3+4Na2S2O3+2H2O=Au2O+2Na2S4O6+4NaOH,故答案为:Na2S2O3;H2O;Au2O;Na2S4O6;NaOH;
(2)Au元素的化合价降低,被还原,S元素的化合价升高,则Na2S2O3为还原剂,故答案为:+3价的Au元素;Na2S2O3;
(3)Au2O3+4Na2S2O3+2H2O=Au2O+2Na2S4O6+4NaOH中,S失去电子,转移4e-,则电子转移的方向和数目可表示为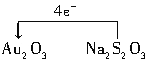 ,故答案为:
,故答案为: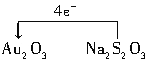 ;
;
(4)反应中Na2S2O3→H2SO4,S硫元素平均化合价由+2价升高为+6价,Na2S2O3是还原剂,Cl2→NaCl、HCl,Cl元素化合价由0价降低为-1价,Cl2是氧化剂,根据电子转移相等,所以n(Na2S2O3)×2×(6-2)=n(Cl2)×2,故n(Na2S2O3):n(Cl2)=1:4,故答案为:1:4。

 暑假衔接培优教材浙江工商大学出版社系列答案
暑假衔接培优教材浙江工商大学出版社系列答案 欣语文化快乐暑假沈阳出版社系列答案
欣语文化快乐暑假沈阳出版社系列答案【题目】工业上设计将VOSO4中的K2SO4、SiO2杂质除去并回收得到V2O5的流程如下:
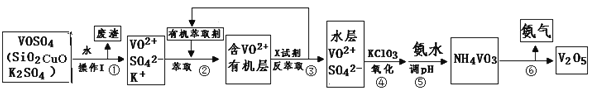
请回答下列问题:
(1)步骤①所得废渣的成分是 (写化学式),操作I的名称 。
(2)步骤②、③的变化过程可简化为(下式R表示VO2+,HA表示有机萃取剂):R2(SO4)n (水层)+ 2nHA(有机层)![]() 2RAn(有机层)+ nH2SO4(水层)
2RAn(有机层)+ nH2SO4(水层)
②中萃取时必须加入适量碱,其原因是 。
③中X试剂为 。
(3)⑤的离子方程式为 。
(4)25℃时,取样进行试验分析,得到钒沉淀率和溶液pH之间关系如下表:
pH | 3 | 4 | 5 | 6 | 7 | 8 | 9 | 0 | 1 |
钒沉淀率% | 88.1 | 94.8 | 96.5 | 98.0 | 98.8 | 98.8 | 96.4 | 93.1 | 89.3 |
结合上表,在实际生产中,⑤中加入氨水,调节溶液的最佳pH为 ;若钒沉淀率为93.1%时不产生Fe(OH)3沉淀,则溶液中c(Fe3+)< 。〖已知:25℃时,Ksp[Fe(OH)3]=2.6×10-39〗
(5)该工艺流程中,可以循环利用的物质有 和 。