题目内容
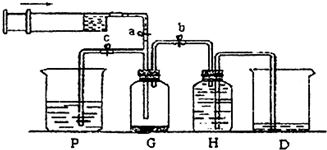
 利用如图所示装置制取Fe(OH)2,通电后溶液中产生的白色沉淀能保持较长时间不变色.下列说法错误的是
利用如图所示装置制取Fe(OH)2,通电后溶液中产生的白色沉淀能保持较长时间不变色.下列说法错误的是
- A.只能用铁作甲电极和乙电极
- B.甲电极上有氢气逸出
- C.烧碱溶液注入容器前,需先煮沸
- D.可用食盐水代替烧碱溶液
A
分析:A.阳极应该用铁电极,阴极用惰性电极亦可;
B.甲为阴极,是溶液中的阳离子氢离子放电;
C.氢氧化亚铁不稳定,容易被空气中的氧气氧化生成红褐色的氢氧化铁;
D.电解液选用NaCl溶液不影响实验,因为阳极是铁失电子生成亚铁离子,溶液中的阴离子不放电;
解答:电解法制备Fe(OH)2 时,采用金属Fe作阳极,阳极方程式为:Fe-2e-=Fe2+;阴极材料可以是铁也可以是其它能导电的材料,阴极方程式为:2H++2e-=H2↑,因为氢离子放电破坏水的电离平衡,使氢氧根离子浓度增大,与亚铁离子结合成Fe(OH)2沉淀,
A.阳极应该用铁电极,阴极可以是铁也可以是其他惰性电极,故A错误;
B.甲为阴极,是溶液中的阳离子氢离子放电,方程式为:2H++2e-=H2↑,故B正确;
C.氢氧化亚铁不稳定,容易被空气中的氧气氧化生成红褐色的氢氧化铁,反应方程式为:4Fe(OH)2+O2+2H2O=4Fe(OH)3,所以,烧碱溶液注入容器前,需先煮沸除尽氧气,故C正确;
D.电解池中阳极是铁失去电子发生氧化反应生成亚铁离子,阴极是溶液中的氢离子得电子发生还原反应,所以电解质溶液中的阴离子不会再阳极失电子,所以选用NaCl溶液不影响实验,故D正确;
故选A.
点评:本题主要考查了氢氧化亚铁沉淀的制备,掌握电解池的原理及其应用是解答的关键,题目难度不大.
分析:A.阳极应该用铁电极,阴极用惰性电极亦可;
B.甲为阴极,是溶液中的阳离子氢离子放电;
C.氢氧化亚铁不稳定,容易被空气中的氧气氧化生成红褐色的氢氧化铁;
D.电解液选用NaCl溶液不影响实验,因为阳极是铁失电子生成亚铁离子,溶液中的阴离子不放电;
解答:电解法制备Fe(OH)2 时,采用金属Fe作阳极,阳极方程式为:Fe-2e-=Fe2+;阴极材料可以是铁也可以是其它能导电的材料,阴极方程式为:2H++2e-=H2↑,因为氢离子放电破坏水的电离平衡,使氢氧根离子浓度增大,与亚铁离子结合成Fe(OH)2沉淀,
A.阳极应该用铁电极,阴极可以是铁也可以是其他惰性电极,故A错误;
B.甲为阴极,是溶液中的阳离子氢离子放电,方程式为:2H++2e-=H2↑,故B正确;
C.氢氧化亚铁不稳定,容易被空气中的氧气氧化生成红褐色的氢氧化铁,反应方程式为:4Fe(OH)2+O2+2H2O=4Fe(OH)3,所以,烧碱溶液注入容器前,需先煮沸除尽氧气,故C正确;
D.电解池中阳极是铁失去电子发生氧化反应生成亚铁离子,阴极是溶液中的氢离子得电子发生还原反应,所以电解质溶液中的阴离子不会再阳极失电子,所以选用NaCl溶液不影响实验,故D正确;
故选A.
点评:本题主要考查了氢氧化亚铁沉淀的制备,掌握电解池的原理及其应用是解答的关键,题目难度不大.

练习册系列答案
 同步学典一课多练系列答案
同步学典一课多练系列答案 经典密卷系列答案
经典密卷系列答案 金牌课堂练系列答案
金牌课堂练系列答案
相关题目
 利用如图所示装置制取Fe(OH)2,通电后溶液中产生的白色沉淀能保持较长时间不变色.下列说法错误的是( )
利用如图所示装置制取Fe(OH)2,通电后溶液中产生的白色沉淀能保持较长时间不变色.下列说法错误的是( )
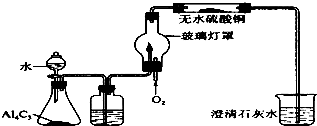 已知Al4C3+12H2O═4Al(OH)3+3CH4↑某学习小组在实验室利用如图所示装置制取甲烷,并验证甲烷的组成.
已知Al4C3+12H2O═4Al(OH)3+3CH4↑某学习小组在实验室利用如图所示装置制取甲烷,并验证甲烷的组成.