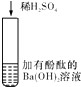题目内容
【题目】关于元素周期表,下列叙述中不正确的是 ( )
A. 在金属元素与非金属元素的分界线附近可以寻找制备半导体材料的元素
B. 在过渡元素中可以寻找制备催化剂及耐高温和耐腐蚀的元素
C. 在非金属元素区域可以寻找制备新型农药材料的元素
D. 在地球上元素的分布和它们在元素周期表中的位置有密切关系
【答案】D
【解析】试题A、在金属元素与非金属元素的分界线附近可以寻找制备半导体材料的元素,正确;B、在过渡元素中可以寻找制备催化剂及耐高温和耐腐蚀的元素,正确;C、在非金属元素区域可以寻找制备新型农药材料的元素,正确;D、在地球上元素的分布和它们在元素周期表中的位置没有必然联系,错误。

练习册系列答案
 小学教材完全解读系列答案
小学教材完全解读系列答案
相关题目
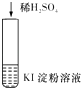
【题目】下列实验现象所对应的离子方程式不正确的是( )
实 验 | 现 象 | 离子方程式 | |
A |
| 在空气中放置一段时间后,溶液呈蓝色 | 4H++4I﹣+O2═2I2+2H2O |
B |
| 溶液由浅绿色变为红色 | 2Fe2++Cl2═2Fe3++2Cl﹣、 |
C |
| 溶液由黄绿色变为无色 | Cl2+2OH﹣═Cl﹣+ClO﹣+H2O |
D |
| 有白色沉淀生成,溶液由红色变为无色 | Ba2++OH﹣+H++SO |
A.A
B.B
C.C
D.D