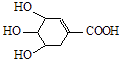
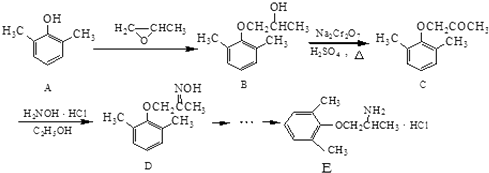
题目内容
【题目】综合利用CO2对环境保护及能源开发意义重大. 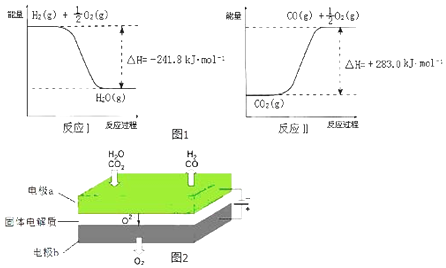
(1)Li2O、Na2O、MgO均能吸收CO2 . 如果寻找吸收CO2的其他物质,下列建议合理的是 . a.可在碱性氧化物中寻找
b.可在ⅠA、ⅡA族元素形成的氧化物中寻找
c.可在具有强氧化性的物质中寻找
(2)利用反应A可将释放的CO2转化为具有工业利用价值的产品.反应A:CO2+H2O ![]() CO+H2+O2已知:如图1所示,则反应A的热化学方程式是 .
CO+H2+O2已知:如图1所示,则反应A的热化学方程式是 .
(3)高温电解技术能高效实现(3)中反应A,工作原理示意图如图2: ①电极b发生(填“氧化”或“还原”)反应.
②CO2在电极a放电的反应式是 .
【答案】
(1)ab
(2)CO2+Li4SiO4 ![]() Li2CO3+Li2SiO3
Li2CO3+Li2SiO3
(3)氧化;CO2+2e﹣═CO+O2﹣
【解析】解:(1)a.Li2O、Na2O、MgO均属于碱性氧化物,均能吸收酸性氧化物CO2 , 可在碱性氧化物中寻找吸收CO2的其他物质,故a正确; b.Li2O、Na2O、MgO均能吸收CO2 , 钠、镁为ⅠA、ⅡA族元素,所以可在ⅠA、ⅡA族元素形成的氧化物中寻找吸收CO2的其他物质,故b正确;
c.Li2O、Na2O、MgO均能吸收CO2 , 但它们都没有强氧化性,且吸收二氧化碳与氧化还原无关,故c错误;
所以答案是:ab;(2)在500℃,CO2与Li4SiO4接触后生成Li2CO3 , 反应物为CO2与Li4SiO4 , 生成物有Li2CO3 , 根据质量守恒可知产物还有Li2SiO3 , 所以化学方程式为:CO2+Li4SiO4 ![]() Li2CO3+Li2SiO3 ,
Li2CO3+Li2SiO3 ,
所以答案是:CO2+Li4SiO4 ![]() Li2CO3+Li2SiO3;(3)①CO2+H2O
Li2CO3+Li2SiO3;(3)①CO2+H2O ![]() CO+H2+O2 , 二氧化碳中的碳元素化合价降低,被还原,水中的氢元素化合价降低被还原,反应物中的氧元素化合价升高,被氧化,失去电子发生氧化反应生成氧气;
CO+H2+O2 , 二氧化碳中的碳元素化合价降低,被还原,水中的氢元素化合价降低被还原,反应物中的氧元素化合价升高,被氧化,失去电子发生氧化反应生成氧气;
所以答案是:氧化;②二氧化碳在a极得到电子发生还原反应生成一氧化碳同时生成氧离子,反应电极反应式为CO2+2e﹣═CO+O2﹣ ,
所以答案是:CO2+2e﹣═CO+O2﹣ .

 世纪百通主体课堂小学课时同步达标系列答案
世纪百通主体课堂小学课时同步达标系列答案 世纪百通优练测系列答案
世纪百通优练测系列答案 百分学生作业本题练王系列答案
百分学生作业本题练王系列答案【题目】某化学兴趣小组发现实验室有多件表面呈灰绿色的金属制品,经了解其来源并查阅相关资料(如下表),初步确认为铜制品.
紫铜 | 青铜 | 铜绿 | |
主要成分 | 纯铜 | 铜锡合金 | Cu2(OH)2CO3 |
性质与用途 | 紫红色,质软,导电性能良好;主要用作电线电缆. | 多呈灰绿色,熔点低、硬度大、可塑性强;可铸造成各种器具. | 不溶于水的灰绿色粉末,溶于酸,加热易分解;可作颜料、杀虫剂. |
针对铜制品表面的灰绿色物质究竟是什么,同学们提出了多种猜想并展开实验探究.
(1)【猜想假设】
小吴同学认为可能是纯铜制品表面涂上了灰绿色的油漆;
小周同学认为可能是青铜(铜锡合金),因为常见的青铜是灰绿色的;
小黄同学认为是纯铜制品,只是表面长出了铜绿[Cu2(OH)2CO3];
除上述猜想外,其他合理的猜想是(只写一个).
(2)【实验验证】三位同学为了验证各自上述的猜想,进行了以下探究:
小吴刮下部分灰绿色物质放入燃烧匙中进行灼烧,发现该物质不能燃烧,证明灰绿色物质不是油漆.其判断依据是 .
(3)小周刮下足量的灰绿色物质投入盐酸溶液中,观察到有气体产生,实验表明该气体不能燃烧.将表面刮净后的铜制品也投入盐酸中,并无气体产生.由此证明该铜制品不是青铜,理由是 .
(4)根据上述实验,小黄认为灰绿色物质可能是铜绿[Cu2(OH)2CO3].于是按如图所示装置进行实验. 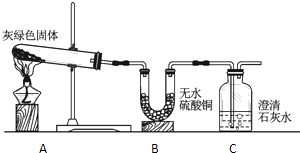
实验证明小黄的猜测是正确的,因为在A中观察到灰绿色物质变黑,B中观察到了的现象,C中观察到了的现象.
B中所发生反应的化学方程式为: .
如果将实验装置中的B和C进行调换,将无法得出灰绿色物质是铜绿的结论,原因是 .
(5)【实验拓展】
小黄同学还从网上找到了利用氨水擦拭去除铜绿的方法,其原理是氨水与碱式碳酸铜反应生成铜氨络离子[Cu(NH3)42+],其离子方程式可表示为: .
【题目】除去下列物质中所含杂质(括号中的物质)所选用的试剂和装置均正确的是( )
Ⅰ.试剂:
①KMnO4/H+②NaOH溶液③饱和Na2CO3溶液④H2O⑤Na⑥Br2/H2O⑦Br2/CCl4
Ⅱ.装置:
选项 | 物质 | 试剂 | 装置 |
A | C2H6(C2H4) | ⑥ | ① |
B | 苯(苯酚) | ① | ③ |
C | CH3COOC2H5(CH3COOH) | ③ | ② |
D | 甲苯(二甲苯) | ⑦ | ④ |