题目内容
下列各组关系正确的是:
| A.原子半径 N<P<S | B.稳定性 NH3<H2O<HF |
| C.碱性 NaOH>KOH | D.酸性 H3AsO4>H2SeO4>HBrO4 |
B
解析试题分析:A、原子半径 N<S<P,错误;B、氢化物稳定性与元素非金属性一致,正确;C、碱性 KOH>NaOH,错误;D、非金属性 As<Se<Br酸性 H3AsO4<H2SeO4<HBrO4,错误。
考点:考查元素周期律有关问题。

练习册系列答案
相关题目
如图是元素周期表短周期元素的一部分。已知M最高价氧化物对应的水化物为常见的氧化性酸,下列说法正确的是: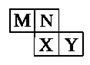
| A.M为氮元素 |
| B.原子半径:Y>X |
| C.氢化物沸点:X>N |
| D.M、X、Y三种元素的最高价氧化物对应的水化物均为强酸 |
短周期元素M、W、X、Y、Z的原子序数依次增大,M元素的一种核素没有中子,且
M、W、X、Y+、Z的最外层电子数与其电子层数的比值依次为1、2、3、4、2(不考虑零族元素)。下列关于这些元素的叙述正确的是( )
| A.X分别和其它四种元素均可形成至少2种化合物 |
| B.M分别和W、X、Y、Z形成化合物,均显相同化合价 |
| C.M、X、Z三种元素组成的化合物含有离子键 |
| D.M、X、Y组成化合物和Y、Z组成化合物,其等物质的量浓度的水溶液中由水电离出的氢离子浓度相同 |
月球上含有丰富的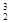 He。关于
He。关于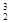 He的说法不正确的是
He的说法不正确的是
| A.是一种核素 | B.原子核内有1个中子 |
C.与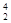 He互为同位素 He互为同位素 | D.比 He少一个电子 He少一个电子 |
元素周期表中铋元素的数据见图,下列说法正确的是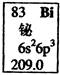
| A.Bi元素的质量数是209 |
| B.Bi元素的相对原子质量是209.0 |
| C.Bi原子6p亚层有一个未成对电子 |
| D.Bi原子最外层有5个能量相同的电子 |
几种短周期元素的原子半径及主要化合价如下表:
| 元素代号 | X | Y | Z | M | R |
| 原子半径/nm | 0.186 | 0.102 | 0.075 | 0.074 | 0.143 |
| 主要化合价 | +1 | +6 -2 | +5 -3 | -2 | +3 |
已知X是短周期中最活泼的金属,且与R同周期。下列叙述错误的是( )
A.离子半径大小:Y2- > M2- > R3+
B.Z与M组成的化合物是形成酸雨的原因之一
C.将YM2通入BaCl2溶液中有大量白色沉淀产生
D.X、Y、R的最高价氧化物的水化物两两之间能发生反应
下列说法正确的是( )
| A.20983Bi和 21083Bi的核外电子数不同 |
B.NH3的电子式为: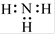 |
| C.全部由非金属元素组成的化合物可能含离子键 |
| D.离子化合物不可能含共价键 |
X、Y、Z、M、N 代表五种金属。有以下化学反应:
①水溶液中:X+Y2+=X2++Y ②Z+2H2O(冷)=Z(OH)2+H2↑
③M、N 为电极与 N 盐溶液组成原电池,发生的电极反应为:M-2e— =M2+
④Y 可以溶于稀 H2SO4中,M 不被稀 H2SO4氧化. 则这五种金属的活泼性由弱到强的顺序是
| A.M<N<Y<X<Z | B.N<M<X<Y<Z |
| C.N<M<Y<X<Z | D.X<Z<N<M<Y |
现有某氯化钠(Na37Cl)6克,其中含钠元素的质量为( )
| A.2克 | B.2.3克 | C.3克 | D.都不对 |