题目内容
某一反应体系中共有As2S3、HNO3、H2SO4、NO、H3AsO4、H2O六种物质,已知As2S3是反应物之一,试写出并配平这个反应方程式并指出氧化产物
解析:由As2S3是反应物知H3AsO4和H3AsO4必为生成物。因为As及S的化合价均升高,As2S3在反应中作为还原剂,在发生氧化还原反应时,必存在一种氧化剂,分析所给物质,只能是HNO3→NO,HNO3作氧化剂,所以可先确定未配平的方程式:
As2S3+HNO3→H3AsO4+H2SO4+NO
水作生成物还是作反应物仍不能确定,先配平主要物质的系数:
每个As2S3化合价升高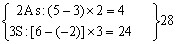
每个HNO3化合价降低:5—2=3
即:3As2S3+28HNO3→6H3AsO4+9H2SO4+28NO
分析方程式两边的H和O原子个数知,反应物缺少8个H原子和4个O原子,应添4个H2O。H3AsO4和H2SO4为氧化产物。
3As2S3+28HNO3+4H2O=6H3AsO4+9H2SO4+28NO
答案:3AsS3+28HNO3+4H2O=6H3AsO4+9H2SO4+28NO,H3AsO4和H2SO4为氧化产物。

练习册系列答案
 口算题天天练系列答案
口算题天天练系列答案
相关题目