题目内容
下列叙述正确的是
| A.标准状况下,1.12 L16O2和1.12 L18O2均含有0.1NA个氧原子 |
| B.第三周期非金属元素含氧酸的酸性从左到右依次增强 |
| C.能使甲基橙显红色的溶液中大量存在:Mg2+、Fe2+、Cl—、NO—3 |
| D.从C(石墨)=C(金刚石);ΔH=+1.9 kJ·mol-1,可知金刚石比石墨更稳定 |
A
解析试题分析:B项应为非金属元素的最高价氧化物的酸性从左到右依次增强;C项溶液为酸性,而Fe2+、NO—3会因氧化还原反应不能大量共存;D项石墨能量小于金刚石,更稳定,错误。
考点:元素周期律、指定条件的离子共存、化学反应中的能量变化。

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
将51.2g铜恰好完全溶于一定量的硝酸溶液中,得到硝酸铜溶液,收集到氮的氧化物(含NO、NO2、N2O4)的混合物共17.92L(标准状况),在这些气体中通入VL(标准状况)的氧气后用一定量的氢氧化钠溶液吸收,结果剩余2.24L(标准状况)气体。则通入氧气的体积V为
| A.7.28L | B.8.96L | C.11.20L | D.16.8L |
以NA表示阿佛加德罗常数,下列说法中正确的是:( )
| A.标准状况下,22.4L苯含有NA个苯分子 |
| B.0.2 mol·L-1 FeCl3溶液中含有Cl-总数为0.6NA |
| C.在标准状况下,含4molHCl的浓盐酸与足量的MnO2反应可生成22.4L氯气 |
| D.4g氦气所含分子数为NA |
用NA表示阿伏加德罗常数的值。下列叙述中正确的是
| A.8 g甲烷含有的共价键数约为NA |
| B.常温常压下,22.4 L二氧化碳原子总数为3NA |
| C.1 mol Fe与稀HNO3反应,一定转移3 NA个电子 |
| D.1mol单质硅含有2molSi-Si键 |
用NA表示阿伏加德罗常数,下列说法正确的是( )
| A.00mL2mol/L葡萄糖溶液中所含分子数为NA |
| B.0.1mol/L Na2CO3溶液中的阴离子总数大于0.1NA |
| C.电解精炼铜时,若阳极质量减少64g,则外电路导线上不一定通过2NA个电子 |
| D.5.6g铁粉在0.1mol氯气中充分燃烧,转移电子数为0.3NA |
设NA为阿伏加德罗常数,下列说法正确的是( )
| A.S2和S8的混合物共6.4g,其中所含硫原子数一定为0.2NA |
| B.将分子总数为NA的NH3和HCl的混合气体置于标准状况下,其体积约为22.4L |
| C.在反应KClO4+8HCl=KCl+4Cl2↑+4H2O中,每生成4molCl2转移的电子数为8NA |
| D.100ml1mol/LAlCl3溶液中含的阳离子数为0.1NA |
下列条件下,两种气体分子数一定不相等的是
| A.相同质量、不同密度的N2O和CO2 |
| B.相同体积、相同密度的N2和C2H4 |
| C.相同温度、相同压强、相同体积的NO2和N2O4 |
| D.相同压强、相同体积、相同质量的O2和O3 |
用NA表示阿伏加德罗常数的值,下列说法中正确的是
| A.1 mol N2所含有的原子数为NA |
| B.标准状况下,22.4 L水中含有的水分子数为NA |
| C.标准状况下,22.4 L氯化氢所含的原子数为NA |
| D.24 g O2分子和24 g O3分子所含的氧原子数目相等 |
下列有关化学用语正确的是( )
A.核内有8个中子的碳原子: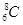 |
| B.CS2的结构式:S—C—S |
C.乙烯的比例模型: |
D.NH4Br的电子式: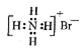 |