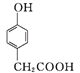
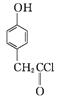
��Ŀ����
����Ŀ����ԭ�������ĵ��������ֶ�����Ԫ�أ�����ĸX��ʾ��ԭ�Ӱ뾶����Դ�С��������ۻ�����۵ı仯������ͼ��ʾ�������жϳ���Ԫ�ػش����⣺


�� f��Ԫ�����ڱ���λ����__________��
�� �Ƚ�d��e�������ӵİ뾶��С���û�ѧʽ��ʾ����ͬ��_______��__________�Ƚ�g��h������������Ӧ��ˮ���������ǿ���ǣ�_______��__________
�� ��ѡ����Ԫ�����һ����ԭ�ӹ��ۻ����д�������ʽ____________________
�� ��֪1mole�ĵ���������d2��ȼ�գ��ָ������£��ų�255.5kJ������д���÷�Ӧ���Ȼ�ѧ����ʽ____________
�� ����Ԫ�ؿ������R��zx4f(gd4)2����ʢ��10mL1mol��L-1R��Һ���ձ��еμ�1mol��L-1NaOH��Һ���������ʵ�����NaOH��Һ����仯ʾ��ͼ������ͼ��ʾ��
�� R��Һ������Ũ���ɴ�С��˳����________________
�� д��m�㷴Ӧ�Ķ����ӷ���ʽ________________________________
�� ��R��Һ�ļ�20mL1.2 mol��L-1Ba(OH)2��Һ������в������������ʵ���Ϊ_______mol��
���𰸡��������ڢ�A�� r(O2-) r(Na+) HClO4 H2SO4 ![]() 2Na(s)+O2(g) ��Na2O2(s) ��H=-511kJ��mol-1 c(SO42-)��c(NH4+)��c(Al3+)��c(H+)��c(OH-) NH4+ + OH-��NH3��H2O 0.022
2Na(s)+O2(g) ��Na2O2(s) ��H=-511kJ��mol-1 c(SO42-)��c(NH4+)��c(Al3+)��c(H+)��c(OH-) NH4+ + OH-��NH3��H2O 0.022
��������
x��ԭ��������С��ԭ�Ӱ뾶Ҳ��С������������ϼ�Ϊ+1�ۣ���X��H��e����������ϼ�Ϊ+1�ۣ�ԭ�Ӱ뾶�����e��Na��y��ԭ��������eС���������Ϊ+4�ۣ���y��C��z��ԭ�������Դ���y����������ϼ�Ϊ+5�ۣ���z��N��d��O��fԭ���������ƴ���������ϼ�Ϊ+3�ۣ���f��Al��g��������ϼ�Ϊ-2�ۣ�ԭ��������������g��S��h�����Ϊ-1�ۣ�ԭ��������������h��Cl���ɴ˷��������
��ͼ�еĻ��ϼۡ�ԭ�Ӱ뾶�Ĵ�С��ԭ������������֪��x��HԪ����y��CԪ����z��NԪ����d��OԪ����e��NaԪ����f��AlԪ����g��SԪ����h��ClԪ����
(1)f��AlԪ����ԭ�Ӻ�����3�����Ӳ�������������Ϊ3����Ԫ�����ڱ���λ���ǵ������ڢ�A����
��ˣ�������ȷ�������������ڢ�A����
(2)���Ӳ�ṹ��ͬ���������˵����Խ�����Ӱ뾶ԽС�������Ӱ뾶��r(O2-)>r(Na+) ���ǽ�����Խǿ�����������ˮ���������Խǿ����������HClO4 >H2SO4��
��ˣ�������ȷ������r(O2-)>r(Na+)��HClO4 >H2SO4��
(3)x��z�γ���ԭ�ӹ��ۻ�����ΪNH3������ʽΪ![]() ��
��
��ˣ�������ȷ������![]() ��
��
(4)��֪1mol�Ƶĵ���������������ȼ�������ɹ������ƹ������ָ����������ų�255.5kJ���������Է�Ӧ���Ȼ�ѧ����ʽΪ��2Na(s)+O2(g) ��Na2O2(s) ��H=-511kJ��mol-1��
��ˣ�������ȷ������2Na(s)+O2(g) ��Na2O2(s) ��H=-511kJ��mol-1��
��5����1molNH4Al(SO4)2����1molNH4+��1molAl3+��2molSO42-���������������Ũ����ߣ���Ϊ����NH3![]() H2O>Al(OH)3��������Խ��Խˮ������֪Al3+ˮ��̶ȴ���NH4+ˮ��̶ȣ���c(NH4+)��c(Al3+)��Al3+��NH4+ˮ�ⶼ���������ӣ���Һ�����ԣ����������ӵ�Ũ�ȴ���������Ũ�ȣ���Һ������Ũ�ȴ�С˳��Ϊ��c(SO42-)��c(NH4+)��c(Al3+)��c(H+)��c(OH-) ��
H2O>Al(OH)3��������Խ��Խˮ������֪Al3+ˮ��̶ȴ���NH4+ˮ��̶ȣ���c(NH4+)��c(Al3+)��Al3+��NH4+ˮ�ⶼ���������ӣ���Һ�����ԣ����������ӵ�Ũ�ȴ���������Ũ�ȣ���Һ������Ũ�ȴ�С˳��Ϊ��c(SO42-)��c(NH4+)��c(Al3+)��c(H+)��c(OH-) ��
��m�㴦�����������ʵ������䣬������ӦΪ��笠����Ӻ����������ӷ�Ӧ��һˮ�ϰ��������ӷ���ʽΪNH4+ + OH-��NH3��H2O��
��20mL1.2 mol��L-1Ba(OH)2��Һ����0.048molOH-��0.024molBa2+��10mL1mol��L-1R��Һ�к���0.01molNH4+��0.01molAl3+��0.02molSO42-����0.048molOH-��ȫ��Ӧ��ʱ������0.002mol Al(OH)3δ�ܽ⣬0.02molSO42-�뱵���ӷ�Ӧ����0.02mol���ᱵ���������������������ʵ���Ϊ0.022mol��
��ˣ�������ȷ������c(SO42-)��c(NH4+)��c(Al3+)��c(H+)��c(OH-)��NH4+ + OH-��NH3��H2O�� 0.022��