题目内容
|
温度一定时,于密闭容器中发生可逆反应:mA(气)+nB(气) | |
| [ ] | |
A. |
平衡向逆反应方向移动 |
B. |
C气体的体积分数增大 |
C. |
气体A的转化率升高 |
D. |
m+n>p |

(1)一定条件下,向一个2L的密闭容器中充入2molN2和6molH2,反应达平衡时放出93kJ热量,生成NH3的浓度为1mol/L,试写出该反应的热化学方程式
(2)现有一支l0mL的试管,充满NO倒置于水槽中,向试管中缓缓通A-定量氧气,当试管内液面稳定时,剩余气体2mL.则通入氧气的体积可能为
(3)一定条件下,某密闭容器中发生反应:4NH3(g)+5O2g)?4NO(g)+6H2O(g).
| 起始浓度(mol. L-1) | c( NH3) | c( O2) | c( NO) | c( H20) |
| 甲 | 1 | 2 | 0 | 0 |
| 乙 | 2 | 4 | 0 | 0 |
| 丙 | 0.5 | x | y | z |
②恒温恒容下,若要使丙与甲平衡时各组分浓度相同,则x=
(4)向容积相同、温度分别为T1和T2的两个密闭容器中分别充入等量NO2,发生反应:2NO2(g)?N2O4(g)△H<0.恒温恒容下反应相同时间后,分别测定体系中NO2的百分含量分别为a1和a2;已知T1<T2,则a1
A.大于 B.小于 c.等于 D.以上都有可能
(5)标准状况下,将干燥纯净的氨和二氧化氮气体分别完成喷泉实验后所得溶液等体积混合,反应后溶液中的离子浓度关系正确的是
A.c(NO-3)>c(NH+4)>c(H+)>c(OH-)
B.c(NH+4)>c(NO-3)>c(OH-)>c(H+)
C.c(H+)=c(OH-)+c(NH3.H2O)
D.c(NH4+)+c(NH3.H2O)=1.5c(NO-3)
氮及其化合物与人类各方面有着密切的联系。Ⅰ现有一支15mL的试管,充满NO倒置于水槽中,向试管中缓缓通入一定量氧气,当试管内液面稳定时,剩余气体3mL。则通入氧气的体积可能为 mL。
Ⅱ目前,消除氮氧化物污染有多种方法。
(1)用CH4催化还原氮氧化物可以消除氮氧化物的污染。已知:
①CH4(g)+4NO2(g)= 4NO(g)+CO2(g)+2H2O(g) △H=-574kJ/mol
②CH4(g)+4NO(g)= 2N2(g)+CO2(g)+2H2O(g) △H=-1160kJ/mol
③H2O(g)= H2O(l) △H=-44kJ/mol
写出CH4(g)与NO2(g)反应生成N2(g) 、CO2(g)和H2O(l)的热化学方程式 。
(2)用活性炭还原法处理氮氧化物,有关反应为: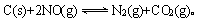
某研究小组向恒容密闭容器加入一定量的活性炭和NO,恒温(T0C)条件下反应,反应进行到不同时间测得各物质的浓度如下:
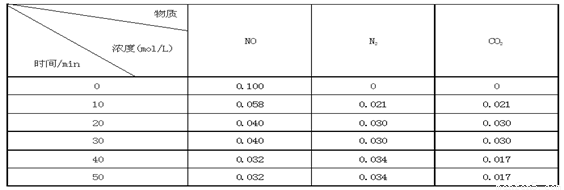
①不能作为判断反应达到化学平衡状态的依据是_______ ;(选填字母代号)
A.容器内CO2的浓度保持不变
B.v正(N2)=2 v正(NO)
C.容器内压强保持不变
D.混合气体的密度保持不变
E.混合气体的平均相对分子质量保持不变
②前20分钟,平均反应速率v(NO)= 。v(NO)=(0.1- 0.04)/ 20 = 0.003mol·L-1· min-1
③在T0C时,该反应的平衡常数为_______(保留两位小数);
④在30 min,改变某一条件反应重新达到平衡,则改变的条件是_______ 。
(3)科学家正在研究利用催化技术将超音速飞机尾气中的NO和CO转变成CO2和N2,其反应为:
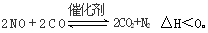
研究表明:在使用等质量催化剂时,增大催化剂的比表面积可提高化学反应速率。为了分别验证温度、催化剂的比表面积对化学反应速率的影响规律,某同学设计了三组实验,部分实验条件已经填在下表中。
|
实验编号 |
T(0C) |
NO初始浓度 (mol/L) |
CO初始浓度 (mol/L) |
催化剂的比 表面积(m2/g) |
|
Ⅰ |
280 |
1.20×10-3 |
5.80×10-3 |
82 |
|
Ⅱ |
a |
b |
c |
124 |
|
Ⅲ |
350 |
d |
e |
124 |
上表中:a=_______,b=________,e=________ 。
氮及其化合物与我们的吃、穿、住、行、健康等都有着密切的联系,也是高中化学学习中重要的一部分。请回答下列问题:
I.(1)现有一支15mL的试管,充满NO倒置于水槽中,向试管中缓缓通入一定量氧气,当试管内液面稳定时,剩余气体3mL。则通入氧气的体积可能为 。
 (2)一定条件下,某密闭容器中发生反应:4NH3(g)+5O2(g)
4NO(g)+6H2O(g)。
(2)一定条件下,某密闭容器中发生反应:4NH3(g)+5O2(g)
4NO(g)+6H2O(g)。
|
起始浓度( mol/L) |
C(NH3) |
C(O2) |
C(NO) |
C(H2O) |
|
甲 |
1 |
2 |
0 |
0 |
|
乙 |
4 |
8 |
0 |
0 |
|
丙 |
0.2 |
x |
y |
z |
①恒温恒容下,平衡时NH3的转化率甲 乙。(填“>”、“=”、或“<”)
②恒温恒容下,若要使丙与甲平衡时各组分浓度相同,则x= ,y= ,z= .
(3)向容积相同、温度分别为T1和T2的两个密闭容器中分别充入等量NO2,发生反应:2NO2(g) N2O4(g)△H<0。恒温恒容下反应相同时间后,分别测定体系中NO2的百分含量分别为a1和a2;已知T1< T2,则a1_
a2。
N2O4(g)△H<0。恒温恒容下反应相同时间后,分别测定体系中NO2的百分含量分别为a1和a2;已知T1< T2,则a1_
a2。
A.大于 B.小于 C.等于 D.以上都有可能
(4)2.24L(标准状况)氨气被200 mL l mol/L HNO3溶液吸收后,反应后溶液中的离子浓度关系是 。
Ⅱ.三氟化氮(NF3)是一种新型的电子材料,它在潮湿的空气中与水蒸气能发生氧化还原反应,其生成物有HF、 NO、 HNO3。根据要求回答下列问题:
(1)写出该反应的化学方程式: 。反应过程中,氧化剂和还原剂物质的量之比为 。
(2)若反应中生成0.2mol HNO3,转移的电子数目为 。
 4NO(g)+6H2O(g)
4NO(g)+6H2O(g) 
 N2O4(g) △H<0。恒温恒容下反应相同时间后,分别测定体系中NO2的百分含量分别为a1和
N2O4(g) △H<0。恒温恒容下反应相同时间后,分别测定体系中NO2的百分含量分别为a1和