题目内容
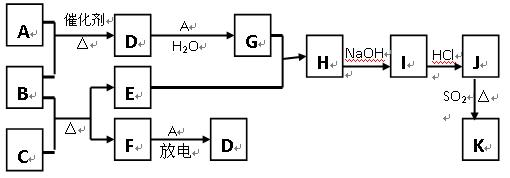
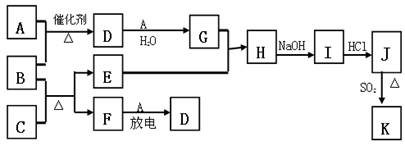
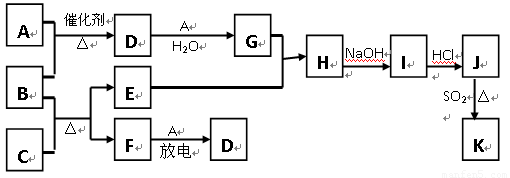
下图涉及的物质所含元素中,除一种元素外,其余均为短周期元素.已知:A、F为无色气体单质,B为具有刺激性气味的气体,C为黑色氧化物,E为红色金属单质(部分反应的产物未列出).请回答下列问题:

(1)B的电子式为
 ;
;
(2)写出B和C反应的化学方程式
(3)写出E与G的稀溶液的离子方程式,并标出电子转移数目:
 ;
;
(4)J、K均是同种金属的氯化物,且K为白色沉淀.写出SO2还原J生成K的离子方程式
(5)汽车尾气中常含有D和CO,二者在催化剂作用下可以大部分转化为两种对空气无污染的物质,已知:F(g)+A(g)=2D (g)△H=+180.5KJ/mol
2C (s)+O2 (g)=2CO(g)△H=-221.0KJ/mol
C (s)+O2(g)=CO2(g)△H=-393.5KJ/mol
则上述尾气转化的热化学方程式为:

(1)B的电子式为


(2)写出B和C反应的化学方程式
3CuO+2NH3
3Cu+N2+3H2O
| ||
3CuO+2NH3
3Cu+N2+3H2O
;
| ||
删除此空
删除此空
(3)写出E与G的稀溶液的离子方程式,并标出电子转移数目:


(4)J、K均是同种金属的氯化物,且K为白色沉淀.写出SO2还原J生成K的离子方程式
2Cu2++2Cl-+SO2+2H2O=2CuCl↓+4H++SO42-
2Cu2++2Cl-+SO2+2H2O=2CuCl↓+4H++SO42-
;(5)汽车尾气中常含有D和CO,二者在催化剂作用下可以大部分转化为两种对空气无污染的物质,已知:F(g)+A(g)=2D (g)△H=+180.5KJ/mol
2C (s)+O2 (g)=2CO(g)△H=-221.0KJ/mol
C (s)+O2(g)=CO2(g)△H=-393.5KJ/mol
则上述尾气转化的热化学方程式为:
2NO(g)+2CO(g)=N2(g)+2CO2(g)△H=-746.5KJ/mol
2NO(g)+2CO(g)=N2(g)+2CO2(g)△H=-746.5KJ/mol
.分析:E为红色金属单质,为Cu,非金属气体单质A、F放电生成D,应是N2+O2
NO,D为NO,结合A+B
D,且B为具有刺激性气味的气体,故A为O2,B为NH3,F为N2;
C为黑色氧化物,由B(为NH3)+C
E(为Cu)+F(为N2)可知C为CuO;
D(为NO)
G,G为HNO3,由Cu+HNO3→H
I
J,J含有金属元素,故H为Cu(NO3)2,I为Cu(OH)2,J为CuCl2,由J(为CuCl2)
K,结合(4)J、K均是同种金属的氯化物,且K为白色沉淀,Cu常见化合价为+1、+2价,K为CuCl,符合氧化还原反应,验证符合转化关系.
| 放电 |
| 催化剂 |
C为黑色氧化物,由B(为NH3)+C
| △ |
D(为NO)
| A |
| H2O |
| NaOH |
| HCl |
| SO2 |
| △ |
解答:解:E为红色金属单质,为Cu,非金属气体单质A、F放电生成D,应是N2+O2
NO,D为NO,结合A+B
D,且B为具有刺激性气味的气体,故A为O2,B为NH3,F为N2;
C为黑色氧化物,由B(为NH3)+C
E(为Cu)+F(为N2)可知C为CuO;
D(为NO)
G,G为HNO3,由Cu+HNO3→H
I
J,J含有金属元素,故H为Cu(NO3)2,I为Cu(OH)2,J为CuCl2,由J(为CuCl2)
K,结合(4)J、K均是同种金属的氯化物,且K为白色沉淀,Cu常见化合价为+1、+2价,K为CuCl,符合氧化还原反应,
(1)B为NH3,分子中氮原子与氢原子之间形成1对共用电子对,电子式为: ;
;
故答案为: ;
;
(2)NH3与CuO反应生成Cu、N2、H2O,反应方程式为:3CuO+2NH3
3Cu+N2+3H2O;
故答案为:3CuO+2NH3
3Cu+N2+3H2O;
(3)Cu与稀硝酸溶液的离子方程式为3Cu+8H++2NO3-=3Cu2++2NO+4H2O,反应中铜元素由0价升高为+2价,转移电子数为6
,标出电子转移数目为: ;
;
故答案为: ;
;
(4)CuCl2与SO2在加热的条件下生成CuCl与硫酸,反应离子方程式为:2Cu2++2Cl-+SO2+2H2O=2CuCl↓+4H++SO42-;
故答案为:2Cu2++2Cl-+SO2+2H2O=2CuCl↓+4H++SO42-;
(5)汽车尾气中常含有NO和CO,二者在催化剂作用下可以大部分转化为两种对空气无污染的物质,为N2、O2,转化反应方程式为:2NO+2CO
N2+2CO2,
已知:①N2(g)+O2(g)=2NO (g)△H=+180.5KJ/mol
②2C (s)+O2 (g)=2CO(g)△H=-221.0KJ/mol
③C (s)+O2(g)=CO2(g)△H=-393.5KJ/mol
由盖斯定律,③×2-①-②得2NO(g)+2CO(g)=N2(g)+2CO2(g)△H=-746.5KJ/mol;
故答案为:2NO(g)+2CO(g)=N2(g)+2CO2(g)△H=-746.5KJ/mol.
| 放电 |
| 催化剂 |
C为黑色氧化物,由B(为NH3)+C
| △ |
D(为NO)
| A |
| H2O |
| NaOH |
| HCl |
| SO2 |
| △ |
(1)B为NH3,分子中氮原子与氢原子之间形成1对共用电子对,电子式为:
 ;
;故答案为:
 ;
;(2)NH3与CuO反应生成Cu、N2、H2O,反应方程式为:3CuO+2NH3
| ||
故答案为:3CuO+2NH3
| ||
(3)Cu与稀硝酸溶液的离子方程式为3Cu+8H++2NO3-=3Cu2++2NO+4H2O,反应中铜元素由0价升高为+2价,转移电子数为6
,标出电子转移数目为:
 ;
;故答案为:
 ;
;(4)CuCl2与SO2在加热的条件下生成CuCl与硫酸,反应离子方程式为:2Cu2++2Cl-+SO2+2H2O=2CuCl↓+4H++SO42-;
故答案为:2Cu2++2Cl-+SO2+2H2O=2CuCl↓+4H++SO42-;
(5)汽车尾气中常含有NO和CO,二者在催化剂作用下可以大部分转化为两种对空气无污染的物质,为N2、O2,转化反应方程式为:2NO+2CO
| ||
已知:①N2(g)+O2(g)=2NO (g)△H=+180.5KJ/mol
②2C (s)+O2 (g)=2CO(g)△H=-221.0KJ/mol
③C (s)+O2(g)=CO2(g)△H=-393.5KJ/mol
由盖斯定律,③×2-①-②得2NO(g)+2CO(g)=N2(g)+2CO2(g)△H=-746.5KJ/mol;
故答案为:2NO(g)+2CO(g)=N2(g)+2CO2(g)△H=-746.5KJ/mol.
点评:本题以无机框图题的形式考查N、S、Cu等元素单质及其化合物之间的相互转化关系和逻辑推理能力、化学用语的书写能力,同时进一步训练学生依据质量守恒定律、氧化还原反应方程式的配平方法书写陌生化学方程式的技能,最后一空引导学生关注人与自然的和谐发展,本题中E为红色金属,非金属气体单质A、B放电生成F等均为解题突破口,推出A、D即可推出G、H.本题中H到K的变化是本题的难点,J到K是学生未知知识,需要结合第(3)问题提示以及氧化还原反应知识进行推理,对学生的逻辑推理能力提出较高要求.

练习册系列答案
相关题目