ΧβΡΩΡΎ»ί
ΓΨΧβΡΩΓΩ¥”Ι≈÷ΝΫώΘ§ΧζΦΑΤδΜ·ΚœΈο‘Ύ»Υάύ…ζ≤ζ…ζΜν÷–ΒΡΉς”ΟΖΔ≈ΘΝΥΨό¥σ±δΜ·ΓΘ
![]() Ι≈¥ζ÷–ΙζΥΡ¥σΖΔΟς÷°“ΜΒΡ÷ΗΡœ’κ «”…¥σ»Μ¥≈ ·÷Τ≥…ΒΡΘ§Τδ÷ς“Σ≥…Ζ÷ «______
Ι≈¥ζ÷–ΙζΥΡ¥σΖΔΟς÷°“ΜΒΡ÷ΗΡœ’κ «”…¥σ»Μ¥≈ ·÷Τ≥…ΒΡΘ§Τδ÷ς“Σ≥…Ζ÷ «______![]() ΧνΉ÷ΡΗ–ρΚ≈
ΧνΉ÷ΡΗ–ρΚ≈![]() ΓΘ
ΓΘ
![]()
![]()
![]()
![]()
![]() ΝρΥα‘ϋΒΡ÷ς“ΣΜ·―ß≥…Ζ÷ΈΣΘΚ
ΝρΥα‘ϋΒΡ÷ς“ΣΜ·―ß≥…Ζ÷ΈΣΘΚ![]() ‘Φ
‘Φ![]() Θ§
Θ§![]() ‘Φ
‘Φ![]() Θ§
Θ§![]() ‘Φ
‘Φ![]() Θ§MgO‘Φ
Θ§MgO‘Φ![]() ”ΟΗΟΖœ‘ϋ÷Τ»Γ“©”ΟΗ®Νœ“ΜΚλ―θΜ·ΧζΒΡ…œ“’Νς≥Χ»γœ¬
”ΟΗΟΖœ‘ϋ÷Τ»Γ“©”ΟΗ®Νœ“ΜΚλ―θΜ·ΧζΒΡ…œ“’Νς≥Χ»γœ¬![]() ≤ΩΖ÷≤ΌΉςΚΆΧθΦ଑
≤ΩΖ÷≤ΌΉςΚΆΧθΦ଑![]() ΘΚ
ΘΚ
 ΜΊ¥πœ¬Ν–Έ ΧβΘΚ
ΜΊ¥πœ¬Ν–Έ ΧβΘΚ
![]() ‘Ύ≤Ϋ÷ηi÷–≤ζ…ζΒΡ”–ΕΨΤχΧεΩ…Ρή”–______ΓΘ
‘Ύ≤Ϋ÷ηi÷–≤ζ…ζΒΡ”–ΕΨΤχΧεΩ…Ρή”–______ΓΘ
![]() ‘Ύ≤Ϋ÷ηii≤ΌΉς÷–Θ§“Σ≥ΐ»ΞΒΡάκΉ”÷°“ΜΈΣ
‘Ύ≤Ϋ÷ηii≤ΌΉς÷–Θ§“Σ≥ΐ»ΞΒΡάκΉ”÷°“ΜΈΣ![]() »τ≥ΘΈ¬ ±
»τ≥ΘΈ¬ ±![]() Θ§¥Υ ±άμ¬έ…œΫΪ
Θ§¥Υ ±άμ¬έ…œΫΪ![]() ≥ΝΒμΆξ»ΪΘ§‘ρ»ή“ΚΒΡpHΈΣ______ΓΘ
≥ΝΒμΆξ»ΪΘ§‘ρ»ή“ΚΒΡpHΈΣ______ΓΘ
![]() ≤Ϋ÷ηiv÷–Θ§…ζ≥…
≤Ϋ÷ηiv÷–Θ§…ζ≥…![]() ΒΡάκΉ”ΖΫ≥Χ Ϋ «______ΓΘ
ΒΡάκΉ”ΖΫ≥Χ Ϋ «______ΓΘ
![]() ¬»Μ·Χζ»ή“Κ≥ΤΈΣΜ·―ß ‘ΦΝ÷–ΒΡΓΑΕύΟφ ÷Γ±Θ§œρ¬»Μ·Ά≠ΚΆ¬»Μ·ΧζΒΡΜλΚœ»ή“Κ÷–Φ”»κ―θΜ·Ά≠ΖέΡ©Μα≤ζ…ζ–¬ΒΡ≥ΝΒμΘ§–¥≥ωΗΟ≥ΝΒμΒΡΜ·―ß Ϋ______ΓΘ«κ”ΟΤΫΚβ“ΤΕ·ΒΡ‘≠άμΘ§ΫαΚœ±Ί“ΣΒΡάκΉ”ΖΫ≥Χ ΫΘ§Ε‘¥Υœ÷œσΉς≥ωΫβ ΆΘΚ______ΓΘ
¬»Μ·Χζ»ή“Κ≥ΤΈΣΜ·―ß ‘ΦΝ÷–ΒΡΓΑΕύΟφ ÷Γ±Θ§œρ¬»Μ·Ά≠ΚΆ¬»Μ·ΧζΒΡΜλΚœ»ή“Κ÷–Φ”»κ―θΜ·Ά≠ΖέΡ©Μα≤ζ…ζ–¬ΒΡ≥ΝΒμΘ§–¥≥ωΗΟ≥ΝΒμΒΡΜ·―ß Ϋ______ΓΘ«κ”ΟΤΫΚβ“ΤΕ·ΒΡ‘≠άμΘ§ΫαΚœ±Ί“ΣΒΡάκΉ”ΖΫ≥Χ ΫΘ§Ε‘¥Υœ÷œσΉς≥ωΫβ ΆΘΚ______ΓΘ
![]() Ι≈άœΕχ…ώΤφΒΡάΕ…Ϊ»ΨΝœΤ’¬≥ ΩάΕΒΡΚœ≥…ΖΫΖ®»γœ¬ΘΚ
Ι≈άœΕχ…ώΤφΒΡάΕ…Ϊ»ΨΝœΤ’¬≥ ΩάΕΒΡΚœ≥…ΖΫΖ®»γœ¬ΘΚ

Η¥Ζ÷ΫβΖ¥”ΠiiΒΡάκΉ”ΖΫ≥Χ Ϋ «______ΓΘ
![]() »γΫώΜυ”ΎΤ’¬≥ ΩάΕΚœ≥…‘≠άμΩ…Φλ≤β ≥ΤΖ÷–
»γΫώΜυ”ΎΤ’¬≥ ΩάΕΚœ≥…‘≠άμΩ…Φλ≤β ≥ΤΖ÷–![]() Θ§ΖΫΑΗ»γœ¬ΘΚ
Θ§ΖΫΑΗ»γœ¬ΘΚ
»τ ‘÷Ϋ±δάΕ‘ρ÷ΛΟς ≥ΤΖ÷–Κ§”–![]() Θ§«κΫβ ΆΦλ≤βΒΡ‘≠άμΘΚ______ΓΘ
Θ§«κΫβ ΆΦλ≤βΒΡ‘≠άμΘΚ______ΓΘ
ΓΨ¥πΑΗΓΩ![]()
![]() ΓΔ
ΓΔ![]() Β»
Β» ![]()
![]()
![]()
![]() Θ§Φ”»κCuO”κ
Θ§Φ”»κCuO”κ![]() Ζ¥”Π…ζ≥…
Ζ¥”Π…ζ≥…![]() ΚΆ
ΚΆ![]() Θ§ΫΒΒΆΝΥ
Θ§ΫΒΒΆΝΥ![]() ≈®Ε»Θ§ ΙΒΟΥ°ΫβΤΫΚβ’ΐœρ“ΤΕ·Θ§…ζ≥…
≈®Ε»Θ§ ΙΒΟΥ°ΫβΤΫΚβ’ΐœρ“ΤΕ·Θ§…ζ≥…![]() ≥ΝΒμ
≥ΝΒμ ![]() Φν–‘ΧθΦΰœ¬Θ§
Φν–‘ΧθΦΰœ¬Θ§![]() ”κ
”κ![]() ΫαΚœ…ζ≥…
ΫαΚœ…ζ≥…![]() ΓΔ
ΓΔ![]() ±ΜΩ’Τχ÷–
±ΜΩ’Τχ÷–![]() ―θΜ·…ζ≥…
―θΜ·…ζ≥…![]() ΓΔ
ΓΔ![]() ”κ
”κ![]() Ζ¥”Π…ζ≥…Τ’¬≥ ΩάΕ Ι ‘÷Ϋœ‘άΕ…Ϊ
Ζ¥”Π…ζ≥…Τ’¬≥ ΩάΕ Ι ‘÷Ϋœ‘άΕ…Ϊ
ΓΨΫβΈωΓΩ
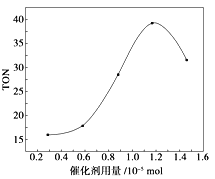
Θ®1Θ©Χλ»Μ¥≈ ·≥…Ζ÷ΈΣΥΡ―θΜ·»ΐΧζΘΜ
Θ®2Θ©ΙΛ“ΒΖœ‘ϋ÷ς“ΣΚ§Fe2O3ΦΑ…ΌΝΩSiO2ΓΔA12O3ΓΔMgOΒ»‘”÷ Θ§Φ”ΟΚ»Φ…’Ω……ζ≥…COΓΔSO2Β»”–ΕΨΤχΧεΘ§Φ”ΝρΥαΚσ÷Μ”–Εΰ―θΜ·Ιη≤ΜΖ¥”ΠΘ§Ιΐ¬Υ≥ΐ»ΞΕΰ―θΜ·ΙηΘ§»ΜΚσΒςΫΎpHΘ§Fe3+ΚΆAl3+Άξ»ΪΉΣΜ·ΈΣ≥ΝΒμΘ§Εχ―«ΧζάκΉ”ΟΜ”–ΉΣΜ·ΈΣ≥ΝΒμΘ§œρ¬Υ“ΚΦ”»κΧΦΥα«βοßΫΪ»ή“Κ÷–Fe2+ΉΣ±δΈΣΧΦΥα―«Χζ≥ΝΒμΘ§Ιΐ¬ΥΒΟΒΫAΈΣΧΦΥα―«ΧζΘ§–η“Σœ¥Β”ΓΔΗ…‘οΘ§»ΜΚσΦ”»»ΒΟΒΫ―θΜ·ΧζΘΜ
Θ®3Θ©Fe3+ΜαΥ°Ϋβ≤ζ…ζΫœΕύΒΡH+ΘΚFe3++3H2O![]() FeΘ®OHΘ©3+3H+Θ§Φ”»κCuO”κH+Ζ¥”Π…ζ≥…Cu2+ΚΆH2OΘ§ΫΒΒΆΝΥH+≈®Ε»Θ§ ΙΒΟΥ°ΫβΤΫΚβ’ΐœρ“ΤΕ·Θ§…ζ≥…FeΘ®OHΘ©3≥ΝΒμΘ§CuO¥ΌΫχΧζάκΉ”Υ°ΫβΘΜ
FeΘ®OHΘ©3+3H+Θ§Φ”»κCuO”κH+Ζ¥”Π…ζ≥…Cu2+ΚΆH2OΘ§ΫΒΒΆΝΥH+≈®Ε»Θ§ ΙΒΟΥ°ΫβΤΫΚβ’ΐœρ“ΤΕ·Θ§…ζ≥…FeΘ®OHΘ©3≥ΝΒμΘ§CuO¥ΌΫχΧζάκΉ”Υ°ΫβΘΜ
Θ®span>4Θ©ΔΌΧζάκΉ””κ[FeΘ®CNΘ©6]4-Ζ¥”Π…ζ≥…Fe4[FeΘ®CNΘ©6]3≥ΝΒμΘΜ
ΔΎ»τ ‘÷Ϋ±δάΕ‘ρ÷ΛΟς ≥ΤΖ÷–Κ§”–CN-Θ§Fe2+”κCN-ΫαΚœ…ζ≥…[FeΘ®CNΘ©6]4-ΘΜFe2+±ΜΩ’Τχ÷–O2―θΜ·…ζ≥…Fe3+ΘΜ[FeΘ®CNΘ©6]4- ”κFe3+Ζ¥”Π…ζ≥…Τ’¬≥ ΩάΕ Ι ‘÷Ϋœ‘άΕ…ΪΓΘ
![]() Ι≈¥ζ÷–ΙζΥΡ¥σΖΔΟς÷°“ΜΒΡΥΨΡœ «”…Χλ»Μ¥≈ ·÷Τ≥…ΒΡΘ§¥≈Χζ≥…Ζ÷÷ς“Σ «ΥΡ―θΜ·»ΐΧζΘΜ
Ι≈¥ζ÷–ΙζΥΡ¥σΖΔΟς÷°“ΜΒΡΥΨΡœ «”…Χλ»Μ¥≈ ·÷Τ≥…ΒΡΘ§¥≈Χζ≥…Ζ÷÷ς“Σ «ΥΡ―θΜ·»ΐΧζΘΜ
Ι ¥πΑΗΈΣΘΚcΘΜ
![]() ”…Ζ÷ΈωΩ…÷ΣΘ§ΓΑΜΙ‘≠±Κ…’Γ±÷–≤ζ…ζΒΡ”–ΕΨΤχΧεΩ…Ρή”–COΓΔ
”…Ζ÷ΈωΩ…÷ΣΘ§ΓΑΜΙ‘≠±Κ…’Γ±÷–≤ζ…ζΒΡ”–ΕΨΤχΧεΩ…Ρή”–COΓΔ![]() Β»ΘΜ
Β»ΘΜ
Ι ¥πΑΗΈΣΘΚCOΓΔ![]() Β»ΘΜ
Β»ΘΜ
![]() ≥ΘΈ¬ ±
≥ΘΈ¬ ±![]() Θ§¥Υ ±άμ¬έ…œΫΪ
Θ§¥Υ ±άμ¬έ…œΫΪ![]() ≥ΝΒμΆξ»ΪΘ§
≥ΝΒμΆξ»ΪΘ§![]() Θ§‘ρ
Θ§‘ρ![]() Θ§
Θ§![]() ΘΜ
ΘΜ
Ι ¥πΑΗΈΣΘΚ5ΘΜ
![]() …ζ≥…
…ζ≥…![]() ΒΡάκΉ”ΖΫ≥Χ Ϋ «ΘΚ
ΒΡάκΉ”ΖΫ≥Χ Ϋ «ΘΚ![]() ΘΜ
ΘΜ
Ι ¥πΑΗΈΣΘΚ![]() ΘΜ
ΘΜ
![]() “ρΈΣ
“ρΈΣ![]() ΜαΥ°Ϋβ≤ζ…ζΫœΕύΒΡ
ΜαΥ°Ϋβ≤ζ…ζΫœΕύΒΡ![]() ΘΚ
ΘΚ![]() Θ§Φ”»κCuO”κ
Θ§Φ”»κCuO”κ![]() Ζ¥”Π…ζ≥…
Ζ¥”Π…ζ≥…![]() ΚΆ
ΚΆ![]() Θ§ΫΒΒΆΝΥ
Θ§ΫΒΒΆΝΥ![]() ≈®Ε»Θ§ ΙΒΟΥ°ΫβΤΫΚβ’ΐœρ“ΤΕ·Θ§…ζ≥…
≈®Ε»Θ§ ΙΒΟΥ°ΫβΤΫΚβ’ΐœρ“ΤΕ·Θ§…ζ≥…![]() ≥ΝΒμΘΜ
≥ΝΒμΘΜ
Ι ¥πΑΗΈΣΘΚ![]() ΘΜ
ΘΜ![]() Θ§Φ”»κCuO”κ
Θ§Φ”»κCuO”κ![]() Ζ¥”Π…ζ≥…
Ζ¥”Π…ζ≥…![]() ΚΆ
ΚΆ![]() Θ§ΫΒΒΆΝΥ
Θ§ΫΒΒΆΝΥ![]() ≈®Ε»Θ§ ΙΒΟΥ°ΫβΤΫΚβ’ΐœρ“ΤΕ·Θ§…ζ≥…
≈®Ε»Θ§ ΙΒΟΥ°ΫβΤΫΚβ’ΐœρ“ΤΕ·Θ§…ζ≥…![]() ≥ΝΒμΘΜ
≥ΝΒμΘΜ
![]() Η¥Ζ÷ΫβΖ¥”ΠiiΒΡάκΉ”ΖΫ≥Χ ΫΈΣΘΚ
Η¥Ζ÷ΫβΖ¥”ΠiiΒΡάκΉ”ΖΫ≥Χ ΫΈΣΘΚ![]() ΘΜ
ΘΜ
Ι ¥πΑΗΈΣΘΚ![]() ΘΜ
ΘΜ
![]() Μυ”ΎΤ’¬≥ ΩάΕΚœ≥…‘≠άμΩ…Φλ≤β ≥ΤΖ÷–
Μυ”ΎΤ’¬≥ ΩάΕΚœ≥…‘≠άμΩ…Φλ≤β ≥ΤΖ÷–![]() Θ§Φν–‘ΧθΦΰœ¬Θ§
Θ§Φν–‘ΧθΦΰœ¬Θ§![]() ”κ
”κ![]() ΫαΚœ…ζ≥…
ΫαΚœ…ζ≥…![]() ΘΜ
ΘΜ![]() ±ΜΩ’Τχ÷–
±ΜΩ’Τχ÷–![]() ―θΜ·…ζ≥…
―θΜ·…ζ≥…![]() ΘΜ
ΘΜ![]() ”κ
”κ![]() Ζ¥”Π…ζ≥…Τ’¬≥ ΩάΕ Ι ‘÷Ϋœ‘άΕ…ΪΘΜ
Ζ¥”Π…ζ≥…Τ’¬≥ ΩάΕ Ι ‘÷Ϋœ‘άΕ…ΪΘΜ
Ι ¥πΑΗΈΣΘΚΦν–‘ΧθΦΰœ¬Θ§![]() ”κ
”κ![]() ΫαΚœ…ζ≥…
ΫαΚœ…ζ≥…![]() ΘΜ
ΘΜ![]() ±ΜΩ’Τχ÷–
±ΜΩ’Τχ÷–![]() ―θΜ·…ζ≥…
―θΜ·…ζ≥…![]() ΘΜ
ΘΜ![]() ”κ
”κ![]() Ζ¥”Π…ζ≥…Τ’¬≥ ΩάΕ Ι ‘÷Ϋœ‘άΕ…ΪΓΘ
Ζ¥”Π…ζ≥…Τ’¬≥ ΩάΕ Ι ‘÷Ϋœ‘άΕ…ΪΓΘ

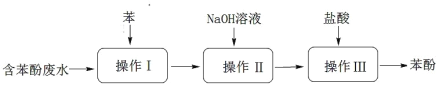
ΓΨΧβΡΩΓΩ”ΟΆΦΥυ ΨΉΑ÷ΟΦλ―ι““œ© ±≤Μ–η“Σ≥ΐ‘”ΒΡ «
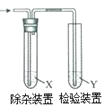
““œ©ΒΡ÷Τ±Η | ‘ΦΝX | ‘ΦΝY | |
A | CH3CH2Br”κNaOH““¥Φ»ή“ΚΙ≤»» | H2O | KMnO4Υα–‘»ή“Κ |
B | CH3CH2Br”κNaOH““¥Φ»ή“ΚΙ≤»» | H2O | Br2ΒΡCCl4»ή“Κ |
C | CH3CH2OH”κ≈®H2SO4Ι≤»»÷Ν170Γφ | NaOH»ή“Κ | KMnO4Υα–‘»ή“Κ |
D | CH3CH2OH”κ≈®H2SO4Ι≤»»÷Ν170Γφ | NaOH»ή“Κ | Br2ΒΡCCl4»ή“Κ |
ΓΨΧβΡΩΓΩAlN–¬–Ά≤ΡΝœ”Π”Ο«ΑΨΑΙψΖΚΘ§Τδ÷Τ±Η”κ–‘÷ ―–ΨΩ≥…ΈΣ»»ΒψΓΘ
œύΙΊ ΐΨί»γœ¬ΘΚ
Έο÷ | »έΒψ/Γφ | Ζ–Βψ/Γφ | ”κN2Ζ¥”ΠΈ¬Ε»/Γφ | œύ”ΠΜ·ΚœΈοΖ÷ΫβΈ¬Ε»/Γφ |
Al | 660 | 2467 | ΘΨ800 | AlNΘΚΘΨ2000 Θ®ΘΨ1400…ΐΜΣΘ© AlCl3ΘΚΘ®ΘΨ181…ΐΜΣΘ© |
Mg | 649 | 1090 | ΘΨ300 | Mg3N2ΘΚΘΨ800 |
(1)AlNΒΡ÷Τ±ΗΓΘ
ΔΌ Μ·―ßΤχœύ≥ΝΜΐΖ®ΓΘ
Δώ.“ΜΕ®Έ¬Ε»œ¬Θ§“‘AlCl3ΤχΧεΚΆNH3ΈΣ‘≠Νœ÷Τ±ΗAlNΘ§Ζ¥”ΠΒΡΜ·―ßΖΫ≥Χ Ϋ «____________________ΓΘ
Δρ.…œ ωΖ¥”Π “ΥΒΡΈ¬Ε»ΖΕΈß «______ΓφΘ®ΧνΉ÷ΡΗΘ©ΓΘ
a.75~100 b.600~1100 c.2000~2300
ΔΎ ¬ΝΖέ÷±Ϋ”ΒΣΜ·Ζ®ΓΘ
Al”κN2Ω…÷±Ϋ”Μ·ΚœΈΣAlNΙΧΧεΘ§AlNΡήΫΪAlΑϋΙϋΘ§Ζ¥”ΠΡ―“‘ΦΧ–χΫχ––ΓΘΩΊ÷ΤΈ¬Ε»Θ§‘ΎAlΖέ÷–Ψυ‘»≤τ»κ ΝΩMgΖέΘ§Ω… ΙAlΦΗΚθ»Ϊ≤ΩΉΣΜ·ΈΣAlNΙΧΧεΓΘΗΟΙΐ≥ΧΖΔ…ζΒΡΖ¥”Π”–ΘΚ__________________ΓΔ_________ΚΆ2Al + N2 ![]() 2AlNΓΘ
2AlNΓΘ
ΔέΧΦ»»ΜΙ‘≠Ζ®ΓΘ
“‘Al2O3ΓΔCΘ® ·ΡΪΘ©ΚΆN2ΈΣ‘≠ΝœΘ§‘ΎΗΏΈ¬œ¬÷Τ±ΗAlNΓΘ
“―÷ΣΘΚΔΓ. 2Al2O3(s) 4Al(g) + 3O2(g) H 1 =ΘΪ3351 kJΓΛmol-1
ΔΔ. 2C( ·ΡΪΘ§s) + O2(g) = 2CO(g) H 2 =Θ≠221 kJΓΛmol-1
ΔΘ. 2Al(g) + N2(g) = 2AlN(s) H 3 =Θ≠318 kJΓΛmol-1
‘Υ”ΟΤΫΚβ“ΤΕ·‘≠άμΖ÷ΈωΖ¥”ΠΔΔΕ‘Ζ¥”ΠΔΓΒΡΩ…Ρή”ΑœλΘΚ______________________________________ΓΘ
(2)AlNΒΡ–‘÷ ΓΘAlNΖέΡ©Ω…ΖΔ…ζΥ°ΫβΓΘœύΆ§ΧθΦΰœ¬Θ§≤ΜΆ§ΝΘΨΕΒΡAlNΖέΡ©Υ°Ϋβ ±»ή“ΚpHΒΡ±δΜ·»γΆΦΥυ ΨΓΘ
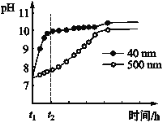
ΔΌ AlNΖέΡ©Υ°ΫβΒΡΜ·―ßΖΫ≥Χ Ϋ «____________________________________ΓΘ
ΔΎ Ϋβ Άt1-t2 ±ΦδΡΎΝΫΧθ«ζœΏ≤ν“λΒΡΩ…Ρή‘≠“ρΘΚ_______________________________ΓΘ
(3)AlNΚ§ΝΩΦλ≤βΓΘœρa g AlN―υΤΖ÷–Φ”»κΉψΝΩ≈®NaOH»ή“ΚΘ§»ΜΚσΆ®»κΥ°’τΤχΫΪNH3»Ϊ≤Ω’τ≥ωΘ§ΫΪNH3”ΟΙΐΝΩΒΡv1 mL c1 molΓΛL-1 H2SO4»ή“ΚΈϋ ’Άξ»ΪΘ§ Θ”ύΒΡH2SO4”Οv2 mL c2 molΓΛL-1 NaOH»ή“Κ«ΓΚΟ÷–ΚΆΘ§‘ρ―υΤΖ÷–AlNΒΡ÷ ΝΩΖ÷ ΐ «________________________________ΓΘ