题目内容
10.下列反应中,表现了二氧化硫氧化性的是( )| A. | 与水反应 | B. | 与溴水反应 | ||
| C. | 使高锰酸钾溶液褪色 | D. | 与硫化氢反应 |
分析 表现了二氧化硫氧化性说明在反应中硫元素化合价降低,据此解答.
解答 解:A.二氧化硫与水化合生成亚硫酸,属于非氧化还原反应,硫元素化合价不变,故A不选;
B.二氧化硫与溴水发生氧化还原反应生成硫酸、氢溴酸,硫元素化合价升高,二氧化硫表现还原性,故B不选;
C.二氧化硫与高锰酸钾溶液发生氧化还原反应,硫元素化合价升高,二氧化硫表现还原性,故C不选;
D.二氧化硫与硫化氢反应生成硫和水,反应中二氧化硫中的硫化合价降低,被还原,表现二氧化硫的氧化性,故D选;
故选:D.
点评 本题考查了二氧化硫的性质,熟悉氧化还原反应中氧化剂、还原剂概念是解题关键,题目难度不大.

练习册系列答案
相关题目
1.《化学反应原理》模块从不同的视角对化学反应进行了探究、分析.以下观点中不正确的是( )
①放热反应在常温下均能自发进行; ②电解过程中,化学能转化为电能而“储存”起来;
③原电池工作时所发生的反应一定有氧化还原反应; ④加热时,放热反应的v(正)会减小;
⑤盐类均能发生水解反应; ⑥化学平衡常数的表达式与化学反应方程式的书写无关.
①放热反应在常温下均能自发进行; ②电解过程中,化学能转化为电能而“储存”起来;
③原电池工作时所发生的反应一定有氧化还原反应; ④加热时,放热反应的v(正)会减小;
⑤盐类均能发生水解反应; ⑥化学平衡常数的表达式与化学反应方程式的书写无关.
| A. | ①②④⑤⑥ | B. | ①④⑤⑥ | C. | ②③⑤⑥ | D. | ①②④⑤ |
18.下列离子方程式中正确的是( )
| A. | 小苏打溶液中加入烧碱溶液:HCO3-+OH-═H2O+C02↑ | |
| B. | 氯化铝溶液中加入过量氨水:Al3++3OH-=Al(OH)3↓ | |
| C. | 向氯化亚铁溶液中加入氯水:2Fe2++Cl2═2Fe3++2Cl- | |
| D. | 二氧化碳通入碳酸钠溶液中:CO2+CO32-+H2O═2HCO3- |
5.下列有关氧化还原反应的叙述正确的是( )
| A. | 元素化合价升高的反应是还原反应 | |
| B. | 物质在变化中失去了电子,此物质中的某一元素化合价降低 | |
| C. | 有电子转移的反应就是氧化还原反应 | |
| D. | 有化合价升降的反应,不一定是氧化还原反应 |
15.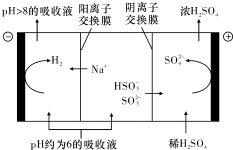 直接排放含SO2的烟气会形成酸雨,危害环境.利用钠碱循环法可脱除烟气中的SO2.
直接排放含SO2的烟气会形成酸雨,危害环境.利用钠碱循环法可脱除烟气中的SO2.
(1)在钠碱循环法中,Na2SO3溶液作为吸收液,可由NaOH溶液吸收SO2制得,该反应的离子方程式是2OH-+SO2=SO32-+H2O
(2)吸收液吸收SO2的过程中,pH随n(SO32-):n(HSO3-)变化关系如下表:
①上表判断NaHSO3溶液显酸性性;
②当吸收液呈中性时,溶液中离子浓度关系正确的是ab(选填字母):
a.c(Na+)=2c(SO32-)+c(HSO3-)
b.c(Na+)>c(HSO3-)>c(SO32-)>c(H+)=c(OH-)
c.c(Na+)+c(H+)=c(SO32-)+c(HSO3-)+c(OH-)
(3)当吸收液的pH降至约为6时,需送至电解槽再生.再生示意图如图:HSO${\;}_{3}^{-}$在阳极放电的电极反应式是HSO3-+H2O-2e-=SO42-+3H+.
 直接排放含SO2的烟气会形成酸雨,危害环境.利用钠碱循环法可脱除烟气中的SO2.
直接排放含SO2的烟气会形成酸雨,危害环境.利用钠碱循环法可脱除烟气中的SO2.(1)在钠碱循环法中,Na2SO3溶液作为吸收液,可由NaOH溶液吸收SO2制得,该反应的离子方程式是2OH-+SO2=SO32-+H2O
(2)吸收液吸收SO2的过程中,pH随n(SO32-):n(HSO3-)变化关系如下表:
| n(SO32-):n(HSO3-) | 91:9 | 1:1 | 9:91 |
| pH | 8.2 | 7.2 | 6.2 |
②当吸收液呈中性时,溶液中离子浓度关系正确的是ab(选填字母):
a.c(Na+)=2c(SO32-)+c(HSO3-)
b.c(Na+)>c(HSO3-)>c(SO32-)>c(H+)=c(OH-)
c.c(Na+)+c(H+)=c(SO32-)+c(HSO3-)+c(OH-)
(3)当吸收液的pH降至约为6时,需送至电解槽再生.再生示意图如图:HSO${\;}_{3}^{-}$在阳极放电的电极反应式是HSO3-+H2O-2e-=SO42-+3H+.
2.下列有关元素的性质及递变规律中错误的是( )
| A. | IA族与VIIA族元素间可形成共价化合物或离子化合物 | |
| B. | 第三周期元素从左到右,最高正价从+1 递增到+7 | |
| C. | 同主族元素的简单阴离子还原性越强,其在水中越容易水解 | |
| D. | 同周期的主族金属元素的化合价越高,其原子失电子能力越弱 |
19.下列叙述中,能肯定A金属比B金属活泼性强的是( )
| A. | A原子的最外层电子数比B原子的最外层电子数少 | |
| B. | A原子的电子层数比B原子的电子层数多 | |
| C. | 1 molA从酸中置换出的H2比1 molB从酸中置换出的氢气多 | |
| D. | 常温时,A能从水中置换出氢气而B不能 |
 人们应用原电池原理制作了多种电池,以满足不同的需要.以下每小题中的电池广泛使用于日常生活、生产和科学技术等方面,请根据题中提供的信息,填写空格.
人们应用原电池原理制作了多种电池,以满足不同的需要.以下每小题中的电池广泛使用于日常生活、生产和科学技术等方面,请根据题中提供的信息,填写空格.