题目内容
已知H2(g)+C12(g) 2HCl(g);△H=-184.6kJ·mol-1,
2HCl(g);△H=-184.6kJ·mol-1,
则反应2HCl(g) H2(g)+Cl2(g)的△H为
H2(g)+Cl2(g)的△H为
A.+92.3 kJ·mol-1 B.-92.3 kJ·mol-1
C.-369.2 kJ·mol-1 D.+184.6 kJ·mol-1
D
【解析】
试题分析:正方应是放热反应,则逆反应是吸热反应,所以该反应的反应热是+184.6 kJ/mol,答案选D。
考点:考查反应热的判断
点评:该题是基础性试题的考查,也是高考中的常见考点,难度不大。该题基础性强,侧重对学生基础知识的巩固和训练。该题的关键是明确正方应和逆反应反应热的关系,然后灵活运用即可。

 名校课堂系列答案
名校课堂系列答案在温度、容积相同的3个密闭容器中,按不同方式投入反应物,保持恒温、恒容,测得反应达到平衡时的有关数据如下[已知N2(g)+3H2(g)  2NH3(g) ΔH=-92.4 kJ/mol]:下列说法正确的是
2NH3(g) ΔH=-92.4 kJ/mol]:下列说法正确的是
|
容器 |
甲 |
乙 |
丙 |
|
反应物投入量 |
1 mol N2、3 mol H2 |
2 mol NH3 |
4 mol NH3 |
|
NH3的浓度(mol/L) |
c1 |
c2 |
c3 |
|
反应的能量变化 |
放出a kJ |
吸收b kJ |
吸收c kJ |
|
体系压强(Pa) |
p1 |
p2 |
p3 |
|
反应物转化率 |
α1 |
α2 |
α3 |
A.2c1>c3 B.a+b>92.4 C.2p2<p3 D.α1+α3<1
在温度、容积相同的2个密闭容器中,按不同方式投入反应物,保持恒温、恒容,测得反应达到平衡时的有关数据如下
(已知N2(g)+3H2(g)
 2NH3(g) △H=-92.4 kJ·mol-1)
2NH3(g) △H=-92.4 kJ·mol-1)
|
容器 |
甲 |
乙 |
|
反应物投入量 |
1 mol N2、3 mol H2 |
4 mol NH3 |
|
NH3的浓度(mol·L-1) |
c1 |
c2 |
|
反应的能量变化 |
放出a kJ |
吸收b kJ |
|
气体密度 |
ρ1 |
ρ2 |
|
反应物转化率 |
α1 |
α2 |
下列说法正确的是
A.c1<c2<2 c1 B.a+b>92.4 C.α1 +α2=1 D.ρ2=2ρ1
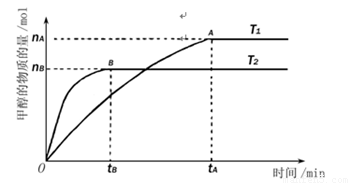
在温度相同的3个密闭容器中,按不同方式投入反应物,保持恒温、恒容,测得反应达到平衡时的有关数据如下(已知CO(g)+2H2(g) CH3OH(g) ΔH=-90.7 kJ/mol):
CH3OH(g) ΔH=-90.7 kJ/mol):
|
容器 |
甲 |
乙 |
丙 |
|
反应物投入量 |
1 mol CO、2 mol H2 |
1 mol CH3OH |
2 mol CH3OH |
|
CH3OH的浓度(mol/L) |
c1 |
c2 |
c3 |
|
反应的能量变化 |
放出a kJ |
吸收b kJ |
吸收c kJ |
|
平衡时压强(Pa) |
P1 |
P2 |
P3 |
|
反应物转化率 |
α1 |
α2 |
α3 |
下列说法不正确的是
A.c1=c3 B.a+c/2<90.7 C.2P2>P3 D.α1+α3=1
(14分)已知CO2(g)+H2(g) CO(g)+H2O(g)的平衡常数随温度变化如下表:
CO(g)+H2O(g)的平衡常数随温度变化如下表:
|
t/℃ |
700 |
800 |
850 |
1 000 |
1 200 |
|
K |
2.6 |
1.7 |
1.0 |
0.9 |
0.6 |
请回答下列问题:
(1)上述正向反应是________反应(选填“放热”或“吸热”)。
(2)若达平衡后降温,则平衡向________移动,CO2转化率________,正反应速率________(选填“增大”、“减小”或“不变”)。
(3)在850℃发生上述反应,以表中的物质的量投入恒容反应器中,其中向正反应方向移动的有________(选填A、B、C、D、E)
|
|
A |
B |
C |
D |
E |
|
n(CO2) |
3 |
1 |
0 |
1 |
1 |
|
n(H2) |
2 |
1 |
0 |
1 |
2 |
|
n(CO) |
1 |
2 |
3 |
0.5 |
3 |
|
n(H2O) |
5 |
2 |
3 |
2 |
1 |
(4)在850℃时,可逆反应:CO2(g)+H2(g) CO(g)+H2O(g),在该容器内各物质的浓度变化如下:
CO(g)+H2O(g),在该容器内各物质的浓度变化如下:
|
时间/min |
CO2 (mol/L) |
H2 (mol/L) |
CO (mol/L) |
H2O (mol/L) |
|
0 |
0.200 |
0.300 |
0 |
0 |
|
2 |
0.138 |
0.238 |
0.062 |
0.062 |
|
3 |
c1 |
c2 |
c3 |
c3 |
|
4 |
c1 |
c2 |
c3 |
c3 |
则3 min~4 min平衡后c3=______________,CO2的转化率为____________。
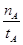 (mol·L-1·min-1)
(mol·L-1·min-1)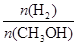 减小
减小