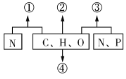
题目内容
【题目】氨气广泛应用于化工、轻工、化肥、制药、合成纤维等领域。
(1)在三个1L的恒容密闭容器中,分別加入0.10molN2和0.30molH2发生反应:N2(g)+3H2(g)![]() 2NH3(g) △H<0,实验Ⅰ、Ⅱ、Ⅲ中c(N2)随时间(t)的变化如图所示(T表示温度)。
2NH3(g) △H<0,实验Ⅰ、Ⅱ、Ⅲ中c(N2)随时间(t)的变化如图所示(T表示温度)。

①与实验Ⅱ相比,实验Ⅰ、实验Ⅲ分别采用的实验条件为_________、_________。
②实验Ⅲ在0~10 min的平均反应速率v(H2)=_________。
(2)分别以N2、H2为电极反应物,HCl-NH4Cl为电解质溶液制造新型燃料电池,试写出该电池正极的电极反应式:______________________。
(3)常温下,将amol/L的氨水与0.01mol/L的盐酸等体积混合,反应达平衡时溶液中c(NH4+)=c(Cl-),则溶液显________性(填“酸”“碱”或“中”);用含a的代数式表示NH3·H2O的电离常数Kb=_________。
(4)工业上用NH3消除NO、NO2 污染。当n(NO)∶n(NO2) =1∶1时,在高温及催化剂条件下,每生成1mol N2放出热量akJ,请书写该反应的热化学方程式:____________________________。
【答案】 升高温度 使用催化剂 0.012 mol/(Lmin) N2+8H++6e-=2NH4+ 中 10-9/(a-0.01) NO(g)+NO2(g)+2NH3(g)=2N2(g)+3H2O(g) ΔH=-2akJ/mo1
【解析】试题分析:本题考查化学平衡图像的分析和化学反应速率的计算,原电池中电极反应式的书写,酸碱混合后溶液酸碱性的判断,电离平衡常数的计算,热化学方程式的书写。
(1)①由图像可见,实验I达到平衡的时间比实验II短,实验I达到平衡时c(N2)的浓度(为0.08mol/L)大于实验II达到平衡时c(N2)的浓度(为0.06mol/L),则T2![]() T1,实验I采用的实验条件为升高温度。由图像可见,实验III达到平衡的时间比实验II短,实验III达到平衡时c(N2)的浓度(为0.06mol/L)等于实验II达到平衡时c(N2)的浓度(为0.06mol/L),实验III采用的条件只影响化学反应速率、不影响化学平衡,实验III采用的实验条件为使用催化剂。
T1,实验I采用的实验条件为升高温度。由图像可见,实验III达到平衡的时间比实验II短,实验III达到平衡时c(N2)的浓度(为0.06mol/L)等于实验II达到平衡时c(N2)的浓度(为0.06mol/L),实验III采用的条件只影响化学反应速率、不影响化学平衡,实验III采用的实验条件为使用催化剂。
②实验III在0~10min内c(N2)由0.10mol/L降至0.06mol/L,υ(N2)=![]() =
=![]() =0.004mol/(L·min),υ(H2)=3υ(N2)=0.012mol/(L·min)。
=0.004mol/(L·min),υ(H2)=3υ(N2)=0.012mol/(L·min)。
(2)在该电池反应中N元素的化合价由0价降至-3价,发生得电子的还原反应,由于电解质溶液呈酸性,N2被还原成NH4+,该电池正极的电极反应式为N2+6e-+8H+=2NH4+。
(3)氨水与盐酸的混合液中存在电荷守恒:c(NH4+)+c(H+)=c(Cl-)+c(OH-),由于c(NH4+)=c(Cl-),则c(H+)=c(OH-),溶液显中性。由于盐酸和氨水等体积混合,则混合液中c(Cl-)=c(NH4+)=![]() =0.005mol/L,溶液中的物料守恒为c(NH4+)+c(NH3·H2O)=
=0.005mol/L,溶液中的物料守恒为c(NH4+)+c(NH3·H2O)=![]() mol/L,则c(NH3·H2O)=(
mol/L,则c(NH3·H2O)=(![]() -0.005)mol/L,NH3·H2O的电离常数Kb=
-0.005)mol/L,NH3·H2O的电离常数Kb=![]() =
=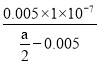 =
=![]() 。
。
(4)当n(NO):n(NO2)=1:1时,反应的化学方程式为2NH3+NO+NO2=2N2+3H2O,由于在高温条件下反应,H2O呈气态,反应的热化学方程式为2NH3(g)+NO(g)+NO2(g)=2N2(g)+3H2O(g)ΔH=-2akJ/mol。

 阅读快车系列答案
阅读快车系列答案【题目】在25 ℃时,密闭容器中X、Y、Z三种气体的初始浓度和平衡浓度如下表:
物质 | X | Y | Z |
初始浓度/mol·L-1 | 0.1 | 0.2 | 0 |
平衡浓度/mol·L-1 | 0.05 | 0.05 | 0.1 |
下列说法正确的是
A. 反应可表示为:X(g)+Y(g) ![]() 2Z(g)
2Z(g)
B. 反应达到平衡时,X的转化率为60%
C. 在此条件下,该反应的平衡常数为K=1600
D. 其他条件不变时,增大压强平衡发生移动,再达新平衡,平衡常数增大