题目内容
已知N2(g) +3H2(g)  2NH3(g) △H =-92.3kJ·mol-1,在一定温度和催化剂的条件下,向一密闭容器中,通入1molN2和3molH2,达到平衡状态I;相同条件下,向另一体积相同的密闭容器中通入0.9molN2、2.7molH2和0.2molNH3,达到平衡状态II,则下列说法正确的是
2NH3(g) △H =-92.3kJ·mol-1,在一定温度和催化剂的条件下,向一密闭容器中,通入1molN2和3molH2,达到平衡状态I;相同条件下,向另一体积相同的密闭容器中通入0.9molN2、2.7molH2和0.2molNH3,达到平衡状态II,则下列说法正确的是
 2NH3(g) △H =-92.3kJ·mol-1,在一定温度和催化剂的条件下,向一密闭容器中,通入1molN2和3molH2,达到平衡状态I;相同条件下,向另一体积相同的密闭容器中通入0.9molN2、2.7molH2和0.2molNH3,达到平衡状态II,则下列说法正确的是
2NH3(g) △H =-92.3kJ·mol-1,在一定温度和催化剂的条件下,向一密闭容器中,通入1molN2和3molH2,达到平衡状态I;相同条件下,向另一体积相同的密闭容器中通入0.9molN2、2.7molH2和0.2molNH3,达到平衡状态II,则下列说法正确的是| A.两个平衡状态的平衡常数的关系:KI < KII | B.H2的百分含量相同 |
| C.N2的转化率:平衡I <平衡II | D.反应放出的热量:QI =QII < 92.3 kJ |
B
试题分析:A中平衡常数为生成物浓度幂的连乘积与反应物浓度幂的连乘积之比,而这两个平衡是等效平衡,所以KI = KII, B选项正确。C选项氮气的转化率相等。D选项由于平衡状态相同,但是平衡状态I放出的能量比平衡状态II大。
点评:抓住等效平衡的特征为最终状态相同。

练习册系列答案
相关题目
 HCO3-+OH-平衡,若通入CO2,则平衡逆向移动
HCO3-+OH-平衡,若通入CO2,则平衡逆向移动
 2NH3(g) ;△H=" —92.4" KJ·mol—1。现在500℃、20 MPa时,将N2、H2置于一个容积为2 L的密闭容器中发生反应,反应过程中各物质的物质的量变化如下图。回答下列问题:
2NH3(g) ;△H=" —92.4" KJ·mol—1。现在500℃、20 MPa时,将N2、H2置于一个容积为2 L的密闭容器中发生反应,反应过程中各物质的物质的量变化如下图。回答下列问题: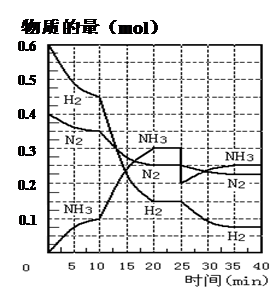
 2HI(g)△ H<0,并达到平衡,HI的体积分数ω(HI)随时间变化如图(Ⅱ)所示。若改变反应条件, ω(HI)的变化曲线如图(Ⅰ)所示,则改变的条件可能是
2HI(g)△ H<0,并达到平衡,HI的体积分数ω(HI)随时间变化如图(Ⅱ)所示。若改变反应条件, ω(HI)的变化曲线如图(Ⅰ)所示,则改变的条件可能是 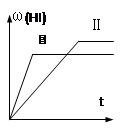
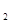 (g)+1/2O
(g)+1/2O SO
SO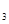 (g)△H=-98.32kJ/mol,现有4molSO
(g)△H=-98.32kJ/mol,现有4molSO CO2(g) +H2 (g),向2 L密闭容器中通入2 mol CO (g)、1 mol H2O (g),2 min后反应达到平衡时,测得CO的物质的量为1.6mol,用H2O (g)表示该反应速率为________此温度下,该反应的平衡常数为________若往容器中再加入2 mol CO (g),则重新达到平衡时的CO总转化率________20%(填“>”、“<”或“=”)。
CO2(g) +H2 (g),向2 L密闭容器中通入2 mol CO (g)、1 mol H2O (g),2 min后反应达到平衡时,测得CO的物质的量为1.6mol,用H2O (g)表示该反应速率为________此温度下,该反应的平衡常数为________若往容器中再加入2 mol CO (g),则重新达到平衡时的CO总转化率________20%(填“>”、“<”或“=”)。
 2Z(g)。此反应达到平衡的标志是 ( )
2Z(g)。此反应达到平衡的标志是 ( )