题目内容
【题目】50mL浓H2SO4溶液(足量)中加入3.2g Cu,在加热条件下充分反应:
(1)反应消耗的H2SO4的物质的量是 , 生成SO2的体积为(标准状况下)mL.
(2)若题干中浓硫酸的物质的量浓度为a molL﹣1 , 投入足量的铜片加热,充分反应后,被还原的硫酸的物质的量n(H2SO4)0.025a mol(填“等于”、“大于”或“小于”).
(3)将题干中反应后的溶液稀释到500mL,取出50mL,并向取出液中加入足量的BaCl2溶液,得到沉淀19.81g,求原浓硫酸的物质的量浓度.
【答案】
(1)0.1mol;1120
(2)小于
(3)解:反应后的溶液加入足量的BaCl2溶液,得到沉淀19.81g为BaSO4,其物质的量= ![]() =0.085mol,可知500mL溶液中n(SO42﹣)=0.085mol×
=0.085mol,可知500mL溶液中n(SO42﹣)=0.085mol× ![]() =0.85MOL,根据S元素守恒可知n(H2SO4)=n(SO42﹣)+n(SO2)=0.85mol+0.05mol=0.9mol,故原浓硫酸的物质的量浓度=
=0.85MOL,根据S元素守恒可知n(H2SO4)=n(SO42﹣)+n(SO2)=0.85mol+0.05mol=0.9mol,故原浓硫酸的物质的量浓度= ![]() =18mol/L,
=18mol/L,
答:原浓硫酸的物质的量浓度为18mol/L
【解析】解:(1)3.2gCu的物质的量= ![]() =0.05mol,由方程式Cu+2H2SO4(浓)=CuSO4+SO2↑+2H2O可知,反应消耗的H2SO4的物质的量=2n(Cu)=2×0.05mol=0.1mol,生成SO2的物质的量=n(Cu)=0.05mol,故生成SO2的
=0.05mol,由方程式Cu+2H2SO4(浓)=CuSO4+SO2↑+2H2O可知,反应消耗的H2SO4的物质的量=2n(Cu)=2×0.05mol=0.1mol,生成SO2的物质的量=n(Cu)=0.05mol,故生成SO2的
体积=0.05mol×22.4L/mol=1.12L=1120mL,
所以答案是:0.1mol;1120;(2)50mL a molL﹣1浓硫酸中硫酸的物质的量=0.05L×a molL﹣1=0.05a mol,投入足量的铜片加热,反应中浓硫酸其氧化剂与酸性作用且各占一半,随反应进行浓硫酸变稀,Cu与稀硫酸不反应,故充分反应后,被还原的硫酸的物质的量n(H2SO4)<0.05a mol× ![]() =0.025a mol,所以答案是:小于;
=0.025a mol,所以答案是:小于;

 阅读快车系列答案
阅读快车系列答案【题目】某科研小组设计出利用工业废酸(10%H2SO4)来堆浸某废弃的氧化铜锌矿的方案,实现废物综合利用,方案如图所示. 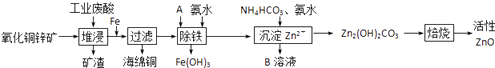
已知:各离子开始沉淀及完全沉淀时的pH如下表所示.
离子 | 开始沉淀时的pH | 完全沉淀时的pH |
Fe2+ | 6.34 | 9.7 |
Fe3+ | 1.48 | 3.2 |
Zn2+ | 6.2 | 8.0 |
请回答下列问题:
(1)氧化铜锌矿中含有少量的CuS和ZnS,在H2SO4的作用下ZnS可以溶解而CuS不溶,则相同温度下:Ksp(CuS)Ksp(ZnS)(选填“>”“<”或“=”).
(2)物质A可使用下列物质中的 .
A.KMnO4
B.O2
C.H2O2
D.Cl2
(3)除铁过程中加入氨水的目的是调节溶液的pH,pH应控制在范围之间.
(4)物质B可直接用作氮肥,则B的化学式是 .
(5)除铁后得到的Fe(OH)3可用KClO溶液在碱性环境将其氧化得到一种高效的多功能水处理剂﹣﹣K2FeO4 , 写出该反应的离子方程式 .