题目内容
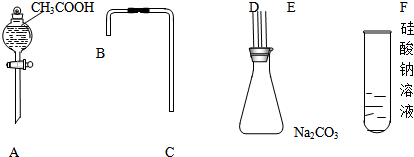
14. Ⅰ.实验室常用如图中的装置制备乙炔并检验乙炔的性质
Ⅰ.实验室常用如图中的装置制备乙炔并检验乙炔的性质(1)实验室制备乙炔的化学方程式是CaC2+2H2O→C2H2↑+Ca(OH)2;
(2)实验过程中,A中分液漏斗通常使用饱和食盐水,其目的是减缓电石与水反应的速率;
(3)B中试剂是硫酸铜溶液;
(4)若C中试剂是溴水,可以观察到的现象是溶液褪色;
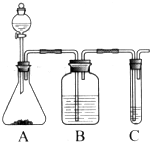
Ⅱ.利用上述装置还可以验证醋酸、苯酚、碳酸的酸性强弱
(1)A中固体试剂是b(选填字母);
a.醋酸钠 b.碳酸氢钠 c.苯酚钠
(2)C中反应的化学方程式是
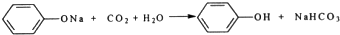 ;
;(3)有同学认为没有B装置,也可以验证酸性的强弱,你认为合理吗?不合理(填“合理”或“不合理”)原因是乙酸有挥发性且能和苯酚钠反应,干扰CO2与苯酚钠的反应.
分析 I、(1)实验室中利用电石和水反应制取乙炔;
(2)电石与水反应速率较快,常利用饱和食盐水代替水制取乙炔;
(3)乙炔气体中常混合有H2S等气体杂质,需要除去;
(4)乙炔中含有碳碳三键,能与溴水反应使其退色;
II、利用强酸制取弱酸原理回答,醋酸的酸性强于碳酸,故装置A中是碳酸氢钠固体,分液漏斗中是醋酸溶液,利用B装置除去挥发出来的乙酸,然后在C中盛放苯酚钠溶液即可验证.
解答 解:Ⅰ.(1)电石与水反应生成乙炔和氢氧化钙,化学反应方程式为:CaC2+2H2O→C2H2↑+Ca(OH)2,故答案为:CaC2+2H2O→C2H2↑+Ca(OH)2;
(2)由于电石与水反应速率较快,不易控制,故常利用饱和食盐水代替水反应制取乙炔,故饱和食盐水的作用是:减缓电石与水反应的速率,故答案为:减缓电石与水反应的速率;
(3)由于制取的乙炔气体中含有硫化氢等气体杂质,CuSO4+H2S=CuS↓+H2SO4,故答案为:硫酸铜溶液;
(4)乙炔中含有碳碳三键,能与溴水发生加成反应使其褪色,故答案为:溶液褪色;
Ⅱ.(1)A中固体试剂是碳酸氢钠,故答案为:b;
(2)苯酚钠与碳酸反应生成苯酚和碳酸氢钠,化学反应方程式为: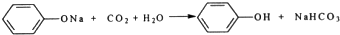 ,故答案为:
,故答案为: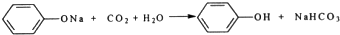 ;
;
(3)由于醋酸具有挥发性,若不除去挥发出来的醋酸,会对后续实验造成干扰,故答案为:不合理,乙酸有挥发性且能和苯酚钠反应,干扰CO2与苯酚钠的反应.
点评 本题主要考查的是乙炔的实验室制取方法以及醋酸、碳酸等酸性强弱的比较实验,综合性较强,有一定难度.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
4.由CH3CH=CH2合成CH2(OOCCH3)CH(OOCCH3)CH2(OOCCH3)时,需要经过的反应( )
| A. | 加成→取代→取代→取代 | B. | 取代→加成→取代→取代 | ||
| C. | 取代→取代→加成→取代 | D. | 取代→取代→取代→加成 |
2.用固体NaOH配制一定物质的量浓度的NaOH溶液,下列操作正确的是( )
| A. | 称量时,将固体NaOH放在小烧杯中,再放在天平左盘上 | |
| B. | 将称量好的固体NaOH放入容量瓶中,加蒸馏水溶解 | |
| C. | 定容时如果加水超过了刻度线,用胶头滴管直接吸出多余部分 | |
| D. | 将烧杯中溶解固体NaOH所得溶液,冷却到室温后转移至容量瓶中 |
19.在金刚石的晶体中,含有由共价键形成的碳原子环,其中最小的环上所需碳原子数及每个碳原子上任意两个C--C键间的夹角是( )
| A. | 6个120° | B. | 5个108° | C. | 4个109°28′ | D. | 6个109°28′ |
6.下列说法正确的是( )
| A. | 浓度、温度、压强、催化剂既是影响反应速率的因素又是影响反应限度的因素 | |
| B. | 合成氨反应在一定条件下达到平衡后,N2、H2、NH3物质的量之比保持恒定 | |
| C. | 化学反应的限度决定于反应物的性质,与外界条件无关 | |
| D. | 增大反应物的用量一定会加快反应速率 |
3. 常用于除去高速公路冰雪的是“氯盐类”融雪剂,如NaCl、MgCl2等,请回答:
常用于除去高速公路冰雪的是“氯盐类”融雪剂,如NaCl、MgCl2等,请回答:
(1)“氯盐类”融雪剂主要成分的晶体类型为离子晶体;
(2)冰比硫化氢热稳定性高的原因是O-H键的键长小于H-S键的键长,硫化氢的分子空间构型为V形;
(3)已知X、Y和Z为第三周期元素,其原子的第一至第四电离能如下表所示:
则X、Y、Z的电负性从大到小的顺序为Al、Mg、Na(用元素符号表示),元素Y第一电离能大于X的原因是因为元素Mg价电子排布式为3s2完全充满状态,比Al稳定;
(4)融雪剂对环境危害很大,如和路基上的铁等金属形成原电池,加快路面破损.铁元素应用广泛,Fe2+与KCN溶液反应得Fe(CN)2沉淀,KCN过量时沉淀溶解,生成配合物黄血盐,配离子结构如图.
①写出铁元素基态原子价电子排布式3d64s2;
②已知CN-与 N2结构相似,1molCN-中π键数目为2NA;
③写出沉淀溶解的化学方程式Fe(CN)2+4KCN=K4[Fe(CN)6].
 常用于除去高速公路冰雪的是“氯盐类”融雪剂,如NaCl、MgCl2等,请回答:
常用于除去高速公路冰雪的是“氯盐类”融雪剂,如NaCl、MgCl2等,请回答:(1)“氯盐类”融雪剂主要成分的晶体类型为离子晶体;
(2)冰比硫化氢热稳定性高的原因是O-H键的键长小于H-S键的键长,硫化氢的分子空间构型为V形;
(3)已知X、Y和Z为第三周期元素,其原子的第一至第四电离能如下表所示:
| 电离能/kJ•mol-1 | I1 | I2 | I3 | I4 |
| X | 578 | 1817 | 2745 | 11578 |
| Y | 738 | 1451 | 7733 | 10540 |
| Z | 496 | 4562 | 6912 | 9543 |
(4)融雪剂对环境危害很大,如和路基上的铁等金属形成原电池,加快路面破损.铁元素应用广泛,Fe2+与KCN溶液反应得Fe(CN)2沉淀,KCN过量时沉淀溶解,生成配合物黄血盐,配离子结构如图.
①写出铁元素基态原子价电子排布式3d64s2;
②已知CN-与 N2结构相似,1molCN-中π键数目为2NA;
③写出沉淀溶解的化学方程式Fe(CN)2+4KCN=K4[Fe(CN)6].
 氯碱工业中电解饱和食盐水的原理示意图如图所示
氯碱工业中电解饱和食盐水的原理示意图如图所示