题目内容
在一定温度下,冰醋酸加水稀释过程中,溶液的导电能力如下图所示,请回答:
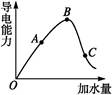
(1)“O”点导电能力为0的理由是 。
(2)A、B、C三点溶液c(H+)由小到大的顺序为 。
(3)若使C点溶液中c(CH3COO-)增大的同时溶液的c(H+)减小,可采取的措施是:
① ;② ;③ 。
(4)经实验测得C点处:c(CH3COOH)="0.1" mol·L-1,c(CH3COO-)="0.01" mol·L-1,则该条件下CH3COOH的电离常数Ka= 。

(1)“O”点导电能力为0的理由是 。
(2)A、B、C三点溶液c(H+)由小到大的顺序为 。
(3)若使C点溶液中c(CH3COO-)增大的同时溶液的c(H+)减小,可采取的措施是:
① ;② ;③ 。
(4)经实验测得C点处:c(CH3COOH)="0.1" mol·L-1,c(CH3COO-)="0.01" mol·L-1,则该条件下CH3COOH的电离常数Ka= 。
(1)CH3COOH是共价化合物,无水不电离,也就无自由移动的离子,所以不导电
(2)C<A<B
(3)加活泼金属(如Mg) 加碱性氧化性(如Na2O) 加碱(如NaOH) 加某些盐(如Na2CO3) 加醋酸盐(如CH3COONa)(任选三种)
(4)1×10-3 mol·L-1
(2)C<A<B
(3)加活泼金属(如Mg) 加碱性氧化性(如Na2O) 加碱(如NaOH) 加某些盐(如Na2CO3) 加醋酸盐(如CH3COONa)(任选三种)
(4)1×10-3 mol·L-1
(1)CH3COOH是一种共价化合物,是弱电解质,共价化合物只有在水溶液里才能电离导电。“O”点不导电说明此时CH3COOH未电离,说明此时无水,不电离,不存在自由移动的离子。
(2)c(H+)越小,导电能力越弱;c(H+)越大,导电能力越强。故c(H+)由小到大的顺序为C<A<B。
(3)欲使c(CH3COO-)增大,可以使平衡右移,即消耗c(H+)的办法,此时可考虑酸的五大通性,其中适合的有加金属、金属氧化物、碱、某些盐;也可以使平衡逆向移动,此时只能加醋酸盐。
(4)由CH3COOH CH3COO-+H+,可知c(H+)=c(CH3COO-)="0.01" mol·L-1,则Ka==1×10-3 mol·L-1。
CH3COO-+H+,可知c(H+)=c(CH3COO-)="0.01" mol·L-1,则Ka==1×10-3 mol·L-1。
(2)c(H+)越小,导电能力越弱;c(H+)越大,导电能力越强。故c(H+)由小到大的顺序为C<A<B。
(3)欲使c(CH3COO-)增大,可以使平衡右移,即消耗c(H+)的办法,此时可考虑酸的五大通性,其中适合的有加金属、金属氧化物、碱、某些盐;也可以使平衡逆向移动,此时只能加醋酸盐。
(4)由CH3COOH
 CH3COO-+H+,可知c(H+)=c(CH3COO-)="0.01" mol·L-1,则Ka==1×10-3 mol·L-1。
CH3COO-+H+,可知c(H+)=c(CH3COO-)="0.01" mol·L-1,则Ka==1×10-3 mol·L-1。
练习册系列答案
 黄冈小状元解决问题天天练系列答案
黄冈小状元解决问题天天练系列答案 三点一测快乐周计划系列答案
三点一测快乐周计划系列答案
相关题目
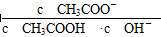 不变
不变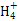 )
)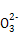 )>c(HC
)>c(HC )
)