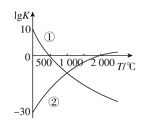
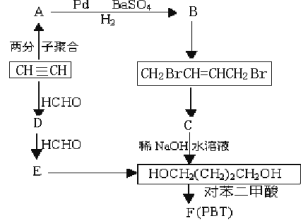
题目内容
【题目】I、乙二酸俗名草酸,为了测定草酸晶体(H2C2O4·xH2O)中的x值。通过查阅资料,草酸易溶于水,水溶液可以用酸性KMnO4溶液进行滴定:2MnO4-+5H2C2O4+6H+=2Mn2++10CO2↑+8H2O,学习小组的同学设计了滴定的方法测定x值。
①称取1.260 g纯草酸晶体,将其制成100.00 mL水溶液为待测液。
②取25.00 mL待测液放入锥形瓶中,再加入适量的稀H2SO4。
③用浓度为0.1000 mol·L-1的酸性KMnO4标准溶液进行滴定,达到终点时消耗10.00 mL。
(1)滴定时,将酸性KMnO4标准液装在____________滴定管(填“酸式”或“碱式”)。
(2)本实验滴定达到终点的标志是__________________________。
(3)通过上述数据,求得x=________。
讨论:
①若滴定终点时俯视滴定管刻度,则由此测得的x值会________(填“偏大”“偏小”或“不变”,下同)。
②若滴定时所用的酸性KMnO4溶液因久置而导致浓度变小,则由此测得的x值会________。
II、(1)25℃时将amolL-1的氨水与0.01molL-1的盐酸等体积混合所得溶液中c(NH4+)=c(Cl-),用含a的代数式表示NH3H2O的电离平衡常数Kb=______
(2)25℃时,H2SO3 ![]() HSO3-+ H+的电离常数Ka = 1×10-2molL-1,则该温度下pH=3、
HSO3-+ H+的电离常数Ka = 1×10-2molL-1,则该温度下pH=3、
c(HSO3-)= 0.1molL-1的NaHSO3 溶液中c(H2SO3)=______.
【答案】酸式 当滴入最后一滴酸性KMnO4溶液时,溶液由无色变为紫色,且半分钟内不褪色,即达滴定终点 2 偏大 偏小 ![]() 0.01mol/L
0.01mol/L
【解析】
I .(1) 酸性KMnO4溶液具有强氧化性,能将橡胶氧化;
(2)草酸与高锰酸钾之间发生氧化还原反应,反应中高锰酸钾既是反应物,也是指示剂,根据高锰酸钾溶液颜色确定滴定终点;
(3) 由已知条件可知滴定过程中消耗的高锰酸钾的物质的量,可进一步计算出草酸的物质的量和质量,从而计算出结晶水的物质的量,根据草酸与结晶水的物质的量之比可得出x的值;
①俯视滴定管,得到的液体的体积偏小,可得出草酸的物质的量偏小;
②滴定时所用的酸性KMnO4溶液久置,消耗的高锰酸钾的体积偏大;
II . (1) 25℃时混合溶液中c(NH4+)=c(Cl-)=0.005mol/L,根据物料守恒得c(NH3H2O)=(0.5a-0.005)mol/L,根据电荷守恒可知c(H+)=c(OH-)=10-7mol/L,溶液呈中性,根据Kb=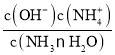 进行计算;
进行计算;
(2)根据亚硫酸第一步电离平衡常数计算亚硫酸的浓度。
I .(1) 酸性KMnO4标准具有强氧化性,能将橡胶氧化,因此将酸性KMnO4标准液装在酸式滴定管中;
(2) 草酸与高锰酸钾之间发生氧化还原反应,反应中高锰酸钾既是反应物,也是指示剂,当滴入最后一滴酸性KMnO4溶液时,溶液由无色变为紫色,且半分钟内不褪色,即达滴定终点;
(3)由已知条件可知滴定25.00mL待测液时消耗KMnO4标准液的物质的量为0.1000 mol·L-1×0.01L=0.001mol,此时消耗的草酸的物质的量为![]() =0.0025mol,那么100.00mL溶液中含有的草酸的物质的量为0.0025mol×4=0.01mol,质量为0.01 mol×90g/ mol=0.9g,那么草酸晶体中结晶水的质量为1.260g-0.9g=0.36g,物质的量为
=0.0025mol,那么100.00mL溶液中含有的草酸的物质的量为0.0025mol×4=0.01mol,质量为0.01 mol×90g/ mol=0.9g,那么草酸晶体中结晶水的质量为1.260g-0.9g=0.36g,物质的量为![]() =0.02mol,因此草酸晶体中草酸和结晶水的物质的量之比为0.01mol:0.02mol=1:2,可得x=2;
=0.02mol,因此草酸晶体中草酸和结晶水的物质的量之比为0.01mol:0.02mol=1:2,可得x=2;
①俯视滴定管,得到的液体的体积偏小,可得出草酸的物质的量偏小,那么结晶水的物质的量偏大,因此x偏大;
②滴定时所用的酸性KMnO4溶液久置,消耗的高锰酸钾的体积偏大,那么x偏小;
II . (1) 25℃时混合溶液中c(NH4+)=c(Cl-)=0.005mol/L,根据物料守恒得c(NH3H2O)=(0.5a-0.005)mol/L,根据电荷守恒可知c(H+)=c(OH-)=10-7mol/L,溶液呈中性,因此Kb=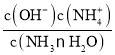 =
=![]() =
=![]() ;
;
(2) 电离常数Ka = 1×10-2molL-1,该温度下pH=3、
c(HSO3-)= 0.1molL-1的NaHSO3 溶液中c(H2SO3)=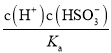 =
=![]() =0.01mol/L。
=0.01mol/L。

 期末冲刺100分创新金卷完全试卷系列答案
期末冲刺100分创新金卷完全试卷系列答案【题目】研究CO2与CH4反应使之转化为CO和H2,对减缓燃料危机和减少温室效应具有重要的意义。工业上CO2与CH4发生反应I:CH4(g)+CO2(g)=2CO(g)+2H2(g) △H1
在反应过程中还发生反应Ⅱ:H2(g)+CO2(g)=H2O(g)+CO(g)△H2=+41kJ/mol
(l)已知部分化学键的键能数据如下表所示:
化学键 | C—H | H—H | C=O |
|
键能(kJ/mol) | 413 | 436 | 803 | 1076 |
则△Hl =____kJ/mol,反应Ⅰ在一定条件下能够自发进行的原因是____,该反应工业生产适宜的温度和压强为____(填标号)。
A.高温高压 B.高温低压 C.低温高压 D.低温低压
(2)工业上将CH4与CO2按物质的量1:1投料制取CO2和H2时,CH4和CO2的平衡转化率随温度变化关系如图所示。

①923K时CO2的平衡转化率大于CH4的原因是________________________
②计算923K时反应II的化学平衡常数K=______(计算结果保留小数点后两位)。
③1200K以上CO2和CH4的平衡转化率趋于相等的原因可能是____。
(3)工业上CH4和CO2反应时通常会掺入O2发生反应
III: CH4+2O2=CO2+2H2O,掺人O2可消除反应产生的积碳和减小反应器的热负荷(单位时间内维持反应发生所需供给的热量),O2的进气量与反应的热负荷的关系如图所示。
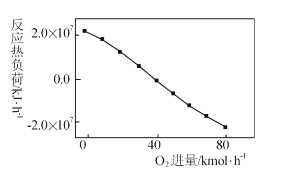
①随着O2进入量的增加,热负荷下降的原因是 ____。
②掺人O2可使CH4的平衡转化率____(填“增大”、“减小”或“不变”。下同),CO2的平衡转化率________