题目内容
【题目】恒温恒容下,将2mol气体A和2mol气体B通入体积为2L的密闭容器中,发生如下反应:2A(g)+B(g)![]() xC(g)+2D(s),2min后反应达到平衡状态,此时剩余1.2mol B,并测得C的浓度为1.2mol/L。
xC(g)+2D(s),2min后反应达到平衡状态,此时剩余1.2mol B,并测得C的浓度为1.2mol/L。
(1)从开始反应到平衡状态,生成C的平均反应速率为__________。
(2)x=_________,该反应的化学平衡表达式为________________。
(3)A的转化率与B的转化率之比为________。
(4)下列各项可作为该反应达到平衡状态的标志是_______(填字母)。
A.压强不再变化 B.气体密度不再变化
C.气体平均相对分子质量不再变化 D.A的消耗速率与B的消耗速率之比为2:1
【答案】 0.6mol·(L·min)-1 3 K=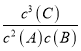 2:1 BC
2:1 BC
【解析】(1)从开始反应至达到平衡状态,生成C的平均反应速率为v(C)= ![]() =
= ![]() = 0.6mol/(L·min);(2)在2min内C的物质的量改变了1.2mol/L×2L=2.4mol,B物质的物质的量减小了2mol-1.2mol-0.8mol,△n(B): △n(C)=0.8mol:2.4mol=1:3,由于物质反应时是按照方程式中系数关系进行反应的,所以C的系数x=3;反应2A(g)+B(g)
= 0.6mol/(L·min);(2)在2min内C的物质的量改变了1.2mol/L×2L=2.4mol,B物质的物质的量减小了2mol-1.2mol-0.8mol,△n(B): △n(C)=0.8mol:2.4mol=1:3,由于物质反应时是按照方程式中系数关系进行反应的,所以C的系数x=3;反应2A(g)+B(g)![]() xC(g)+2D(s)的化学平衡表达式为K=
xC(g)+2D(s)的化学平衡表达式为K=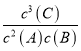 ;(3)根据方程式可知A、B两种物质发生反应时物质的量的比是2:1,由于B反应的物质的量是0.8mol,所以A反应的物质的量是1.6mol,反应开始时二者的物质的量相等,所以A的转化率与B的转化率之比等于二者反应的物质的量的比,为2:1;(4)A.该反应是反应前后气体体积相等的反应,任何时刻气体的物质的量都不变,压强也不变,则不能根据压强不再变化判断反应达到平衡状态,选项A错误;B.该反应是反应前后气体的质量改变的反应,由于容器的容积不变,所以气体密度不再变化,说明反应达到平衡状态,选项B正确;C.该反应是反应前后气体的质量改变的反应,气体的物质的量不变,若气体平均相对分子质量不再变化,则反应达到平衡状态,选项C正确;D.A的消耗速率与B的消耗速率之比为2:1,表明反应正向进行的反应速率按计量数之比进行,不能判断反应达到平衡状态,选项D错误。答案选BC。
;(3)根据方程式可知A、B两种物质发生反应时物质的量的比是2:1,由于B反应的物质的量是0.8mol,所以A反应的物质的量是1.6mol,反应开始时二者的物质的量相等,所以A的转化率与B的转化率之比等于二者反应的物质的量的比,为2:1;(4)A.该反应是反应前后气体体积相等的反应,任何时刻气体的物质的量都不变,压强也不变,则不能根据压强不再变化判断反应达到平衡状态,选项A错误;B.该反应是反应前后气体的质量改变的反应,由于容器的容积不变,所以气体密度不再变化,说明反应达到平衡状态,选项B正确;C.该反应是反应前后气体的质量改变的反应,气体的物质的量不变,若气体平均相对分子质量不再变化,则反应达到平衡状态,选项C正确;D.A的消耗速率与B的消耗速率之比为2:1,表明反应正向进行的反应速率按计量数之比进行,不能判断反应达到平衡状态,选项D错误。答案选BC。

【题目】下列各组物质中,满足表中图示物质在通常条件下一步转化关系的组合只有( )
序号 | X | Y | Z | W |
|
① | CuO | Cu(OH)2 | CuSO4 | Cu | |
② | NaCl | NaHCO3 | Na2CO3 | NaOH | |
③ | Cl2 | Ca(ClO)2 | HClO | HCl | |
④ | SO2 | H2SO3 | Na2SO3 | NaHSO3 |
A.①②③
B.①③④
C.②③④
D.①②④