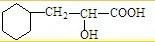
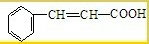
题目内容
(2009?肇庆一模)下列实验操作或所记录的数据合理的是( )
分析:A.玻璃中含有SiO2能与碱反应有黏性的Na2SiO3;
B.溴水见光易分解,用棕色瓶盛装;
C.氯水为氯气的水溶液,显酸性,其中的次氯酸有漂白性;
D.配制完后,要加铁粉和稀硫酸,铁粉是还原被氧化的二价铁,稀硫酸是抑制硫酸亚铁的水解.
B.溴水见光易分解,用棕色瓶盛装;
C.氯水为氯气的水溶液,显酸性,其中的次氯酸有漂白性;
D.配制完后,要加铁粉和稀硫酸,铁粉是还原被氧化的二价铁,稀硫酸是抑制硫酸亚铁的水解.
解答:解:A.因玻璃中含有SiO2,SiO2能与碱反应SiO2+2NaOH═Na2SiO3 +H2O,生成有黏性的Na2SiO3,会导致玻璃塞打不开,所以装浓NaOH溶液的试剂瓶不能用玻璃塞密封,故A错误;
B.液溴应盛放在用水密封且用玻璃塞塞紧的棕色试剂瓶中液溴容易挥发,所以要密封保存,且会加入少量的水密封.在水中有:Br2+H2O
HBr+HBrO,加热或光照,都会促进反应.所以,要避光,用棕色的瓶子.但是由于溴水溶液呈酸性,会腐蚀橡胶塞,所以,只能用玻璃塞,故B正确;
C.氯水为氯气的水溶液,显酸性,其中的次氯酸有漂白性,不能用pH试纸测,故C错误;
D.应该加要加铁粉和稀硫酸,铁粉可以还原被氧化的二价铁,硫酸亚铁易水解,需要增大氢离子浓度,防止水解,故D错误.
故选B.
B.液溴应盛放在用水密封且用玻璃塞塞紧的棕色试剂瓶中液溴容易挥发,所以要密封保存,且会加入少量的水密封.在水中有:Br2+H2O
| 可逆 |
C.氯水为氯气的水溶液,显酸性,其中的次氯酸有漂白性,不能用pH试纸测,故C错误;
D.应该加要加铁粉和稀硫酸,铁粉可以还原被氧化的二价铁,硫酸亚铁易水解,需要增大氢离子浓度,防止水解,故D错误.
故选B.
点评:本题考查化学试剂的存放、PH试纸的使用、溶液的配制,难度不大,注意配制硫酸亚铁溶液要加铁粉和稀硫酸,铁粉是还原被氧化的二价铁,稀硫酸是抑制硫酸亚铁的水解.

练习册系列答案
 名校课堂系列答案
名校课堂系列答案
相关题目
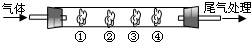
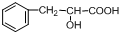 (2009?肇庆一模)有机物A是一种重要化工生产的中间体,其结构简式如下:
(2009?肇庆一模)有机物A是一种重要化工生产的中间体,其结构简式如下: