题目内容
已知:C(s) + O2(g)
 CO2(g) ΔH=-437.3 kJ?mol-1
CO2(g) ΔH=-437.3 kJ?mol-1
H2(g) +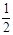 O2(g)
O2(g)  H2O(g) ΔH=-285.8 kJ?mol-1
H2O(g) ΔH=-285.8 kJ?mol-1
CO(g) +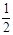 O2(g)
O2(g)  CO2(g) ΔH=-283.0 kJ?mol-1
CO2(g) ΔH=-283.0 kJ?mol-1
则固态碳与水蒸汽反应生成一氧化碳和氢气的热化学方程式是
【答案】
) C(s)+H2O(g)==CO(g)+H2(g) DH =+131.5kJ/mol
【解析】
试题分析:固态碳与水蒸汽反应生成一氧化碳和氢气的的热化学方程式是C(s)+H2O(g)==CO(g)+H2(g) ,DH ="X" kJ/mol,它可以由C(s)
+ O2(g)  CO2(g)减去H2(g)
+
CO2(g)减去H2(g)
+ 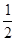 O2(g)
O2(g)  H2O(g) 再减去CO(g) +
H2O(g) 再减去CO(g) + 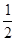 O2(g)
O2(g)  CO2(g)得到,所以DH
=-437.3-(-285.8-283.0)=131.5kJ/mol,所以固态碳与水蒸汽反应生成一氧化碳和氢气的热化学方程式是C(s)+H2O(g)==CO(g)+H2(g) DH
=+131.5kJ/mol。
CO2(g)得到,所以DH
=-437.3-(-285.8-283.0)=131.5kJ/mol,所以固态碳与水蒸汽反应生成一氧化碳和氢气的热化学方程式是C(s)+H2O(g)==CO(g)+H2(g) DH
=+131.5kJ/mol。
考点:热化学方程式的书写
点评:本题考查了热化学方程式的书写,注意要标明各物质的状态。本题不难。

练习册系列答案
 中考解读考点精练系列答案
中考解读考点精练系列答案 各地期末复习特训卷系列答案
各地期末复习特训卷系列答案
相关题目
 +4)制取纳米级TiO2的流程如下:
+4)制取纳米级TiO2的流程如下: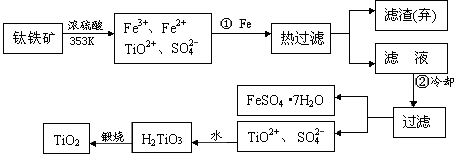
 TiCl4
TiCl4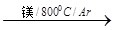 Ti
Ti  2CO(g);DH>0。该反应达到平衡后,下列条件有利于反应向正方向进行的是
2CO(g);DH>0。该反应达到平衡后,下列条件有利于反应向正方向进行的是