题目内容
【题目】下列事实,不能用勒夏特列原理解释的是
A. 溴水中有如下平衡:Br2+H2OHBr+HBrO,加入AgNO3溶液后,溶液颜色变浅
B. 合成NH3反应,为提高NH3的产率,理论上应采取相对较低温度的措施
C. 氯气在水中的溶解度大于在饱和食盐水中的溶解度
D. 对CO(g)+NO2(g)CO2(g)+NO(g)平衡体系增大压强可使颜色变深
【答案】D
【解析】
勒夏特列原理为:如果改变影响平衡的条件之一,平衡将向着能够减弱这种改变的方向移动,使用勒夏特列原理时,该反应必须是可逆反应,否则勒夏特列原理不适用.
A、当加入AgNO3溶液后,硝酸银和HBr反应生成AgBr沉淀,促进平衡正向移动,溴浓度降低溶液颜色变浅,可以用勒夏特列原理解释,故A不选;
B、合成氨是反应前后气体体积减小的放热可逆反应,降低温度促进平衡正向移动,提高氨气产率,可以勒夏特列原理解释,故B不选;
C、氯水中存在Cl2+H2O![]() H++Cl-+HClO,在饱和食盐水中Cl-浓度大,抑制平衡向正方向移动,氯气溶解度变小,能用勒夏特列原理解释,故C不选;
H++Cl-+HClO,在饱和食盐水中Cl-浓度大,抑制平衡向正方向移动,氯气溶解度变小,能用勒夏特列原理解释,故C不选;
D、增大压强时二氧化氮浓度增大导致气体颜色加深,与平衡移动原理无关,所以不能用勒夏特列原理解释,故D选;
故选D。

【题目】中共十九大报告指出,加快水污染防治、实施流域环境和近岸海域综合治理、环境污染的治理是化学工作者研究的重要课题,也是践行“绿水青山就是金山银山”的重要举措。在适当的条件下,将CO2转化为甲醇、甲醚等有机物,既可降低CO2造成的温室效应对环境的影响,还可得到重要的有机产物。
(1)已知:①2H2(g)+O2(g)=2H2O(g) ΔH1=484 kJ/mol
②CO2(g)+3H2(g) ![]() CH3OH(g)+H2O(g) ΔH2=50 kJ/mol
CH3OH(g)+H2O(g) ΔH2=50 kJ/mol
则2CH3OH(g)+3O2(g)= 2CO2(g)+4H2O(g) ΔH,ΔH=_____________。
(2)已知T K时,某恒容密闭容器中存在如下反应:2CO2(g)+6H2(g) ![]() CH3OCH3(g)+3H2O(g) ΔH<0,测得容器中不同时刻时各物质的浓度(mol/L)如下表所示:
CH3OCH3(g)+3H2O(g) ΔH<0,测得容器中不同时刻时各物质的浓度(mol/L)如下表所示:
c(CO2) | c(H2) | c(CH3OCH3) | c(H2O) | |
开始时 | a | b | 0 | 0 |
10 s时 | 3 | 0.5 | c | 1.5 |
①若反应开始到10s时间段内,v(H2)=_____________,既能提高反应速率,又能提高H2转化率的方法是________________________。
②若T K时,化学平衡常数K=15,则10 s 时v(正)_______v(逆)(填“>”“<”或“=”),此时CO2的转化率为________。
(3)一定条件下,向某恒容密闭容器中充入x mol CO2和y mol H2,发生的反应为CO2(g)+3H2(g) ![]() CH3OH(g)+H2O(g) ΔH=50 kJ·mol1。
CH3OH(g)+H2O(g) ΔH=50 kJ·mol1。
①下图1中能表示该反应的平衡常数K与温度T之间的变化关系曲线为______(填“a”或“b”),其判断依据是__________________________________。
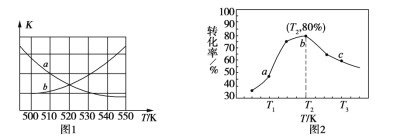
②若x=2、y=3,测得在相同时间内不同温度下H2的转化率如图2所示,则在该时间段内,恰好达到化学平衡时,容器内的压强与反应开始时的压强之比为____________。