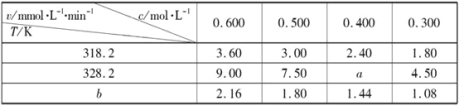
题目内容
【题目】下列热化学方程式,正确的是( )
A.4g固体硫完全燃烧生成SO2,放出37 kJ热量:S(s)+O2(g)=SO2(g) ΔH= -296kJ/mol
B.1molN2与3molH2在某密闭容器中反应放出73kJ热量,则反应的热化学方程式为:
N2(g)+3H2(g)![]() 2NH3(g) △H= -73kJ/mol
2NH3(g) △H= -73kJ/mol
C.甲烷的标准燃烧热为-890.3kJ·mol-1,则甲烷燃烧的热化学方程式可表示为:
CH4(g)+2O2(g) ==CO2(g)+ 2H2O(g) ΔH=-890.3kJ·mol-1
D.强酸强碱的中和热为- 57.3 kJ/mol:
Ba(OH) 2(aq)+H2SO4(aq)=BaSO4(S)+2H2O(l) ΔH=-114.6kJ/mol
【答案】A
【解析】4g固体硫完全燃烧生成SO2,放出37 kJ热量,1mol固体硫完全燃烧生成SO2,放出37 ×8kJ热量:S(s)+O2(g)=SO2(g) ΔH= -296kJ/mol,故A项正确;1molN2与3molH2在某密闭容器中反应放出73kJ热量,因为反应是可逆的,不能进行到底,故反应的热化学方程式为:N2(g)+3H2(g)![]() 2NH3(g) △H<-73kJ/mol,B项错误;甲烷的标准燃烧热为
2NH3(g) △H<-73kJ/mol,B项错误;甲烷的标准燃烧热为
-890.3kJ·mol-1,H2O为液态,故甲烷燃烧的热化学方程式可表示为:CH4(g)+2O2(g) ==CO2(g)+ 2H2O(l) ΔH=-890.3kJ·mol-1,C项错误;强酸强碱的中和热为- 57.3 kJ/mol,而
Ba(OH) 2(aq)+H2SO4(aq)=BaSO4(s)+2H2O(l)有BaSO4(s)生成,故ΔH<-114.6 kJ/mol,D项错误;

练习册系列答案
 名校课堂系列答案
名校课堂系列答案
相关题目