题目内容
【题目】已知 A、B、D、H 是中学化学中常见的单质,其中 A、D 为气体,J 为蓝色溶液。转化关系如下(部分生成物及反应条件已略去):
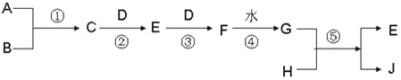
(1)若 B 为气体时,当用玻璃棒分别蘸取 C、G 的浓溶液并使它们靠近时,有白烟生成。则
①请写出下列物质的化学式C__________,F______________。
②在溶液中,检验白烟中阳离子的方法__________________。
(2)若B为固体时,已知 E 是一种常见的空气污染物,且将 C 与 E 混合可生成淡黄色固体 B,写出 G 与 H 反应的化学方程式_____,简述检验气体E的方法_____。
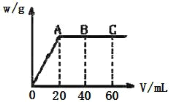
(3)若G 分别是HNO3 和H2SO4,取两者的混合溶液 10 mL,加入0.25molL﹣1Ba(OH)2 溶液时,生成沉淀的质量 w(g)和 Ba(OH)2 溶液的体积 V(mL)的关系如图所示(C 点混合液呈中性)。则原混合液中 H2SO4 的物质的量浓度为_________mol·L-1,HNO3 的物质的量浓度为_____________mol·L-1。
【答案】NH3 NO2 取少量溶液于试管,加入氢氧化钠溶液并加热,试管口湿润红色石蕊试纸变蓝,含有 NH4+(其他合理答案即可) Cu+2H2SO4(浓)![]() CuSO4+SO2↑+2H2O 通入品红溶液,使其褪色(其他合理答案即可) 0.5 2
CuSO4+SO2↑+2H2O 通入品红溶液,使其褪色(其他合理答案即可) 0.5 2
【解析】
A、B、D、H是中学化学中常见的单质,J为蓝色溶液,应含有铜离子,根据各物质的转化关系,
(1)若A、B均为气体时,当用玻璃棒分别蘸取C、G的浓溶液并使它们靠近时,有白烟生成,应为HCl或HNO3和NH3的反应生成NH4Cl,由于C连续与单质D反应后又与水反应生成G,则C为NH3,D为O2,E为NO,F为NO2,G为HNO3,A、B应为氮气和氢气,硝酸与铜反应生成硝酸铜和NO,所以H为Cu,J为Cu(NO3)2;
(2)若A为气体,B为固体时,已知C在D中完全燃烧可生成E和水,E是一种常见的空气污染物,且将C与E混合可生成淡黄色固体B,则A为H2,B为S,C为H2S,D为O2,E为SO2,F为SO3,G为H2SO4,浓硫酸与铜反应生成硫酸铜和SO2,所以H为Cu,J为CuSO4,据此答题。
(3)根据图像以及反应方程式进行计算。
A、B、D、H是中学化学中常见的单质,J为蓝色溶液,应含有铜离子,根据各物质的转化关系,
(1)若A、B均为气体时,当用玻璃棒分别蘸取C、G的浓溶液并使它们靠近时,有白烟生成,应为HCl或HNO3和NH3的反应生成NH4Cl,由于C连续与单质D反应后又与水反应生成G,则C为NH3,D为O2,E为NO,F为NO2,G为HNO3,A、B应为氮气和氢气,硝酸与铜反应生成硝酸铜和NO,所以H为Cu,J为Cu(NO3)2,
①根据上面的分析可知,C为NH3,F为NO2,故答案为:NH3,NO2。
②有白烟生成,是因为生成了氯化铵,在溶液中,检验铵根离子的方法为:取少量溶液于试管中,加入氢氧化钠溶液并加热,在试管口能使湿润的红色石蕊试纸变蓝,说明含有NH4+,故答案为:取少量溶液于试管中,加入氢氧化钠溶液并加热,在试管口能使湿润的红色石蕊试纸变蓝,说明含有NH4+。
(2)若A为气体,B为固体时,已知C在D中完全燃烧可生成E和水,E是一种常见的空气污染物,且将C与E混合可生成淡黄色固体B,则A为H2,B为S,C为H2S,D为O2,E为SO2,F为SO3,G为H2SO4,浓硫酸与铜反应生成硫酸铜和SO2,所以H为Cu,J为CuSO4,G与H反应的化学方程式为Cu+2H2SO4(浓)![]() CuSO4+SO2↑+2H2O,检验气体SO2的方法是将气体体SO2通入品红溶液,溶液褪色,加热后恢复红色,证明E是SO2,
CuSO4+SO2↑+2H2O,检验气体SO2的方法是将气体体SO2通入品红溶液,溶液褪色,加热后恢复红色,证明E是SO2,
故答案为:Cu+2H2SO4(浓)![]() CuSO4+SO2↑+2H2O;将气体体SO2通入品红溶液,溶液褪色,加热后恢复红色,证明E是SO2。
CuSO4+SO2↑+2H2O;将气体体SO2通入品红溶液,溶液褪色,加热后恢复红色,证明E是SO2。
(3)由图像可知,0~20mL氢氧化钡溶液发生H2SO4+Ba(OH)2=BaSO4↓+2H2O,即加入20mL氢氧化钡溶液时,硫酸钡沉淀量达到最大,则根据反应方程式可知硫酸的物质的量为:n(H2SO4)=n[Ba(OH)2]=0.25mol/L×0.020L=0.005mol,硫酸的物质的量浓度为0.005mol÷0.01L=0.5mol/L,

【题目】下表所列各组物质中,物质之间通过一步反应就能实现如图所示转化的是
a | b | c | |
① | Cu | CuO | Cu(OH)2 |
② | CH3CH2OH | CH3CHO | CH2=CH2 |
③ | S | SO3 | H2SO4 |
④ | NO | NO2 | HNO3 |
⑤ | FeCl2 | Fe | FeCl3 |

A. ②⑤ B. ③④ C. ④⑤ D. ①⑤

