题目内容
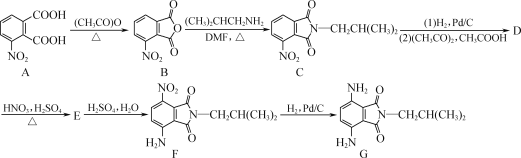
【题目】CuCl常用作催化剂,石油工业中脱硫与脱色,是一种不溶于水和乙醇的白色粉末,在潮湿空气中可被迅速氧化。某课外学习小组用辉铜矿(主要成分为Cu2S,少量的Fe2O3和SiO2)制取氯化亚铜的流程如下:
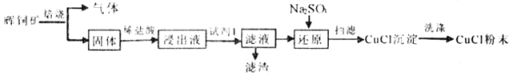
(1)“焙烧”过程发生反应的化学方程式___________;为加快浸取速率常采取的措施___________(写两条)。
(2)加入“试剂1”可调节浸出液的pH,“试剂1”可以是___________;“滤渣”的成分是___________(填化学式)。
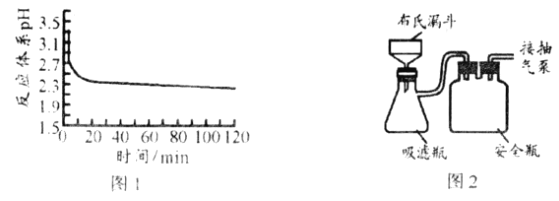
(3)①图1是反应体系pH随时间的变化关系图。写出“还原”制备CuCl的离子方程式___________。
②制备过程中,当n(Na2SO3)与n(CuCl2)比值过大时CuCl产率会变小,其原因可能是_________。
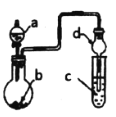
(4)反应完成后经抽滤、洗涤、干燥获得产品。图2为抽滤”装置,抽气泵可使吸滤瓶和安全瓶内压强减小,与普通过滤相比,采用抽滤的优点是___________。
(5)CuCl沉淀的“洗涤”需要经过酸洗、水洗和醇洗。用“去氧水洗后再用“乙醇”洗涤的原因是_______。
(6)取1.0g制备的CuCl粉末样品,先加入足量FeCl3溶液使其完全溶解,再稀释到100mL,从中取出25.00mL,用0.1mol·L-1Ce(SO4)2标准液滴定至终点[Ce(SO4)2被还原为Ce2(SO4)3];三次滴定平消耗标准液的体积为22.00mL。则粉末中CuCl的质量分数为___________。
【答案】Cu2S+2O2![]() 2CuO+SO2 将固体粉碎、升高温度(或适当增大盐酸的浓度等) CuO[或Cu(OH)2,或CuCO3] Fe(OH)3、SiO2 2Cu2++SO32-+2Cl-+H2O=2CuCl↓+SO42-+2H+ n(Na2SO3)与n(CuCl2)比值越大,溶液的碱性越强,Cu2+及CuCl的水解程度增大,故CuCl的产率下降 加快过滤速度,避免长时间接触空气 快速去除CuCl沉淀表面的水分,防止其潮湿被氧化 88%
2CuO+SO2 将固体粉碎、升高温度(或适当增大盐酸的浓度等) CuO[或Cu(OH)2,或CuCO3] Fe(OH)3、SiO2 2Cu2++SO32-+2Cl-+H2O=2CuCl↓+SO42-+2H+ n(Na2SO3)与n(CuCl2)比值越大,溶液的碱性越强,Cu2+及CuCl的水解程度增大,故CuCl的产率下降 加快过滤速度,避免长时间接触空气 快速去除CuCl沉淀表面的水分,防止其潮湿被氧化 88%
【解析】
分析题中的流程过程,辉铜矿焙烧,将Cu2S初步转化为CuO和SO2,所得的固体为CuO、Fe2O3、SiO2的混合物,再用稀盐酸对所得固体进行酸浸,得到成分为FeCl3、CuCl2、稀盐酸、SiO2的浸出液。加入试剂1用于调节溶液的pH值,同时将Fe3+转化为Fe(OH)3沉淀而除去,SiO2在这个过程中不参与反应,也以滤渣的形式除去。向滤液中加入Na2SO3,Na2SO3与Cu2+发生氧化还原反应,将Cu2+还原为Cu+,形成CuCl沉淀。将CuCl沉淀洗涤,最终得到CuCl粉末,据此分析。
(1)“焙烧”过程主要是除去可燃性杂质或使原料初步转化,本题为使原料初步转化,发生的化学反应方程式为:Cu2S+2O2![]() 2CuO+SO2;增大原料浸取速率的措施有:将原料粉碎、搅拌、升高温度、增大盐酸的浓度等,故答案为:Cu2S+2O2
2CuO+SO2;增大原料浸取速率的措施有:将原料粉碎、搅拌、升高温度、增大盐酸的浓度等,故答案为:Cu2S+2O2![]() 2CuO+SO2;将固体粉碎、升高温度(或适当增大盐酸的浓度等);
2CuO+SO2;将固体粉碎、升高温度(或适当增大盐酸的浓度等);
(2)由流程图可知,加入试剂1可调节浸出液的pH,也可将Fe3+转化为Fe(OH)3沉淀而除去,同时也不引入新的杂质,故符合条件的为CuO[或Cu(OH)2,或CuCO3];由分析可知,滤渣为:Fe(OH)3、SiO2;答案为:CuO[或Cu(OH)2,或CuCO3];Fe(OH)3、SiO2;
(3)①由分析可知,Na2SO3与Cu2+发生氧化还原反应,将Cu2+还原为Cu+,形成CuCl沉淀。其离子方程式为:2Cu2++SO32-+2Cl-+H2O=2CuCl↓+SO42-+2H+;答案为:2Cu2++SO32-+2Cl-+H2O=2CuCl↓+SO42-+2H+;
②Na2SO3为强碱弱酸盐,水解显碱性,n(Na2SO3)与n(CuCl2)比值越大,溶液的碱性越强,Cu2+及CuCl的水解程度增大,故CuCl的产率下降;答案为:n(Na2SO3)与n(CuCl2)比值越大,溶液的碱性越强,Cu2+及CuCl的水解程度增大,故CuCl的产率下降;
(4)抽滤的优点为加快过滤速度,避免长时间接触空气;答案为:加快过滤速度,避免长时间接触空气;
(5)乙醇易挥发,进而可快速去除CuCl沉淀表面的水分,防止其潮湿被氧化。故答案为:快速去除CuCl沉淀表面的水分,防止其潮湿被氧化;
(6)由题可知,涉及的离子反应方程式为:CuCl+Fe3+=Cu2++Fe2++Cl-、Ce4++Fe2+=Ce3++Fe3+,可得关系式:CuCl~Ce4+,则CuCl的质量分数=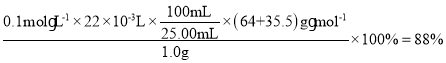 。答案为:88%。
。答案为:88%。

 小学数学口算题卡脱口而出系列答案
小学数学口算题卡脱口而出系列答案 优秀生应用题卡口算天天练系列答案
优秀生应用题卡口算天天练系列答案 浙江之星课时优化作业系列答案
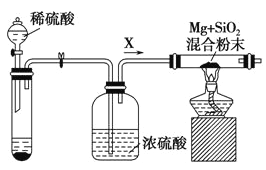
浙江之星课时优化作业系列答案【题目】用如图装置进行实验,将液体a逐滴加到固体b中,下列叙述正确的是
选项 | a | b | c | 现象 | 装置图 |
A | 浓H2SO4 | Cu | 澄清石灰水 | c中溶液变浑浊 |
|
B | 浓盐酸 | KMnO4晶体 | 紫色石蕊溶液 | c中溶液最终呈红色 | |
C | 稀HNO3 | Fe | NaOH溶液 | d中红棕色气体变浅 | |
D | 浓氨水 | 生石灰 | Al2(SO4)3溶液 | c中产生沉淀后溶解 |
A.AB.BC.CD.D