题目内容
【题目】现有 0.175 mol·L-1醋酸钠溶液500 mL,(已知室温下,醋酸的电离平衡常数Ka=1.75×10-5)。
⑴ 写出醋酸钠水解反应的化学方程式______________________________;
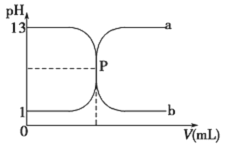
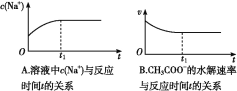
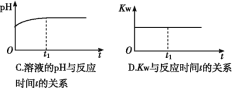
⑵ (双选)下列图象能说明醋酸钠的水解反应达到平衡的是____________;
⑶ (双选)向醋酸钠溶液中加入少量下列物质,水解平衡向正向移动的有______;
A.冰醋酸 B.纯碱固体 C.醋酸钠固体 D.氯化铵固体
⑷ (双选)在醋酸钠溶液中加入冰醋酸,溶液中微粒浓度的关系式能成立的有__________;
A.c(CH3COO-) + c(CH3COOH) > c(Na+)
B.c(Na+) > c(CH3COO-) > c(H+) > c(OH-)
C.c(CH3COO-) > c(Na+) > c(H+) > c(OH-)
D.c(CH3COO-) > c(H+) > c(OH-) > c(Na+)
⑸ 欲配制0.175 mol·L-1醋酸钠溶液500 mL,可采用以下两种方案:
方案一:用托盘天平称取___________g无水醋酸钠,溶于适量水中,配成500 mL溶液。[已知:M(CH3COONa) = 82g/mol ]
方案二:用体积均为250 mL且浓度均为___________mol·L-1的醋酸与氢氧化钠两溶液混合而成(设混合后的体积等于混合前两者体积之和)。
⑹ 在室温下,0.175 mol·L-1醋酸钠(CH3COONa)溶液的pH约为__________。
【答案】(1)CH3COONa +H2O![]() CH3COOH+NaOH
CH3COOH+NaOH
(2)BC(选1个给1分,见错不给分)
(3)CD
(4)AC
(5)7.2(答7.175的给1分),0.35mol/L(无单位给1分)
(6)9
【解析】
试题(1)醋酸钠水解生成醋酸和氢氧化钠,化学方程式为CH3COONa +H2O![]() CH3COOH+NaOH
CH3COOH+NaOH
(2)A、钠离子不水解,所以浓度始终不变,错误;B、醋酸根离子开始时水解速率最大,后逐渐减小,平衡时不在变化,正确;C、随着水解的逐渐进行,pH逐渐增大,平衡时不在变化,正确;D、KW是一温度常数,温度不变,KW不变,错误,答案选BC。
(3)A、加入冰醋酸溶液中醋酸浓度增大,平衡左移,错误;B、加入纯碱固体,对平衡体系的离子浓度无影响,平衡不移动,错误;C、加入醋酸钙固体,溶液在醋酸根离子浓度增大,平衡右移,正确;D、加入氯化铵固体,铵根离子与水解生成的氢氧根离子结合成一水合氨,使溶液中氢氧根离子浓度减小,平衡右移,正确,答案选CD。
(4)A、加入冰醋酸,使醋酸根离子浓度增大,但钠离子浓度不变,所以A正确;B、加入少量冰醋酸,平衡左移,醋酸根离子浓度增大,大于钠离子浓度,错误;C、加入冰醋酸,当溶液中醋酸浓度较大时,醋酸的电离大于醋酸根离子的水解程度,醋酸根离子浓度增大,溶液呈酸性,正确;D、无论是否电离程度大于水解程度,都不会存在c(OH-)>c(Na+),错误,答案选AC。
(5)有m=nM得醋酸钠的质量为7.175g,所以托盘天平称量的质量为7.2g;醋酸与氢氧化钠等浓度等体积混合,混合后的溶液浓度减半为0.175mol/L,所以原来的浓度为0.35mol/L
(6) 醋酸根的水解反应的平衡常数
K=Kw/Ka(CH3COOH)=c(CH3COOH)c(OH-)/c(CH3COO-)= c(OH-)2/c(CH3COO-),所以c(OH-)=10-5,Ph=9

 小学夺冠AB卷系列答案
小学夺冠AB卷系列答案【题目】甲醇被称为2l世纪的新型燃料,工业上通过下列反应Ⅰ和Ⅱ,用CH4和H2O为原料来制备甲醇。
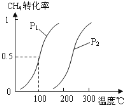
⑴①将1.0 mol CH4和2.0 mol H2O(g)通入容积100L的反应室,一定条件下发生反应:CH4(g) + H2O(g) CO(g) + 3H2(g)
Ⅰ,CH4的转化率与温度、压强的关系如图。已知100℃时达到平衡所需的时间为5min,则用H2表示的平均反应速率为:_____________;
②图中的压强P1_________P2(填“大于”、“小于”或“等于”),100℃时的平衡常数为:_______;
③在其它条件不变的情况下降低温度,逆反应速率将__________(填“增大”、“减小”或“不变”)。
⑵在压强为0.1 MPa条件下, 将a mol CO与 3amol H2的混合气体在催化剂作用下能自发反应生成甲醇:CO(g) + 2H2(g) CH3OH(g)
Ⅱ。①若容器容积不变,下列措施可提高甲醇产率的是:________________;
A.升高温度 B.将CH3OH(g)从体系中分离
C.充入He,使体系总压强增大 D.加入更高效的催化剂
②为了寻找合成甲醇的适宜温度和压强,某同学设计了三组实验,部分实验条件已经填在下面实验设计的表中,请帮他完成该表。
实验编号 | T(℃) | n (CO)/n(H2) | P(MPa) |
A | 150 | 1/3 | 0.1 |
B | Ⅰ | Ⅱ | 5 |
C | 350 | 1/3 | Ⅲ |
表中Ⅰ、Ⅱ、Ⅲ分别为:__________、____________、____________。
【题目】下表是氧化镁和氯化镁的熔、沸点数据:请参考以上数据分析,从海水中提取镁,正确的方法是( )
物质 | 氧化镁 | 氯化镁 |
熔点/℃ | 2852 | 714 |
沸点/℃ | 3600 | 1410 |
A. 海水![]() Mg(OH)2
Mg(OH)2![]() Mg
Mg
B. 海水![]() MgCl2溶液
MgCl2溶液![]() MgCl2晶体
MgCl2晶体![]() Mg
Mg
C. 海水![]() Mg(OH)2
Mg(OH)2![]() MgO
MgO![]() Mg
Mg
D. 海水![]() Mg(OH)2
Mg(OH)2![]() MgCl2溶液
MgCl2溶液![]() MgCl2(熔融)
MgCl2(熔融) ![]() Mg
Mg
【题目】化学反应速率是通过实验测定的,下列化学反应速率的测量中,测量依据不可行的是( )
选项 | 化学反应 | 测量依据(单位时间内) |
A | 2NO2 | 颜色深浅 |
B | Zn+H2SO4=ZnSO4+H2 | H2体积 |
C | CO(g)+H2O(g)=CO2(g)+H2(g) | 压强变化 |
D | Ca(OH)2+Na2CO3=CaCO3↓+2NaOH | 沉淀质量 |