题目内容
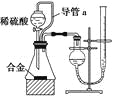
【题目】氮化镁常用于制备其它超硬、高导热、耐高温的氮化物,实验室用以下装置制取氮化镁。已知:Mg+2NH3![]() Mg(NH2)2+H2,Mg3N2是一种浅黄色粉末,易水解。下列说法不正确的是
Mg(NH2)2+H2,Mg3N2是一种浅黄色粉末,易水解。下列说法不正确的是
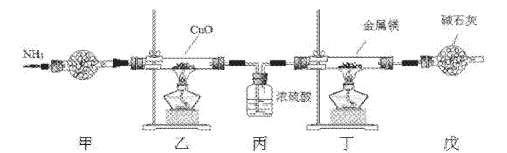
A. 实验开始时应先点燃乙处酒精灯,再点燃丁处酒精灯
B. 装置乙的目的是制备N2
C. 装置丙与装置戊可以对调
D. 取装置丁所得固体少许,滴入少量蒸馏水,可检验是否有Mg3N2
【答案】C
【解析】
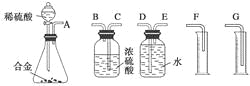
本实验按从左到右的顺序,甲中盛有碱石灰,用于干燥氨气,乙中发生3CuO![]() 2NH3
2NH3![]() 3Cu
3Cu![]() 3H2O
3H2O![]() N2
N2![]() 用以制取氮气,丙用浓硫酸干燥氮气并吸收多余的NH3,防止在丁Mg3N2水解及发生Mg+2NH3
用以制取氮气,丙用浓硫酸干燥氮气并吸收多余的NH3,防止在丁Mg3N2水解及发生Mg+2NH3![]() Mg(NH2)2+H2,丁中发生3Mg
Mg(NH2)2+H2,丁中发生3Mg![]() N2
N2![]() Mg3N2,戊中盛用碱石灰的干燥管,用于防止空气中的水分和Mg3N2作用,使Mg3N2水解。
Mg3N2,戊中盛用碱石灰的干燥管,用于防止空气中的水分和Mg3N2作用,使Mg3N2水解。
A.实验开始时应先点燃乙处酒精灯,制取N2并排除装置内空气,再点燃丁处酒精灯,故A正确;
B.装置乙的目的是3CuO![]() 2NH3
2NH3![]() 3Cu
3Cu![]() 3H2O
3H2O![]() N2
N2![]() 用以制取氮气,故B正确;
用以制取氮气,故B正确;
C.装置丙是用来干燥氮气并吸收多余的NH3,防止Mg+2NH3![]() Mg(NH2)2+H2,而装置戊是防止空气中的水蒸气进入丁中,其中通常盛放的碱石灰不能吸收NH3,所以丙、戊不可以对调,故C错误;
Mg(NH2)2+H2,而装置戊是防止空气中的水蒸气进入丁中,其中通常盛放的碱石灰不能吸收NH3,所以丙、戊不可以对调,故C错误;
D.因Mg3N2![]() 6H2O=3Mg(OH)3
6H2O=3Mg(OH)3![]() 3NH3
3NH3![]() ,所以取装置丁所得固体少许,滴入少量蒸馏水,若有刺激性气味的气体生成,则证明固体中有Mg3N2,故D正确;
,所以取装置丁所得固体少许,滴入少量蒸馏水,若有刺激性气味的气体生成,则证明固体中有Mg3N2,故D正确;
本题答案为C。

 南大教辅抢先起跑暑假衔接教程南京大学出版社系列答案
南大教辅抢先起跑暑假衔接教程南京大学出版社系列答案【题目】某探究性学习小组利用H2C2O4溶液与酸性KMnO4溶液之间的反应来探究外界条件改变对化学反应速率的影响。实验如表所示,下列有关说法中正确的是( )
实验 序号 | 实验温度/K | 酸性KMnO4溶液 | H2C2O4溶液 | H2O | 溶液褪至无色时所用时间/s | ||
V/mL | c/mol·L-1 | V/mL | c/mol·L-1 | V/mL | |||
A | 293 | 2 | 0.02 | 5 | 0.1 | 3 | t1 |
B | T1 | 2 | 0.02 | 3 | 0.1 | V1 | 8 |
C | 313 | 2 | 0.02 | V2 | 0.1 | 5 | t1 |
A.配制KMnO4溶液时可用稀盐酸酸化
B.若t1<8,则可通过控制变量法由实验A、B探究H2C2O4浓度对化学反应速率的影响并得出结论:增大反应物浓度,化学反应速率加快
C.若span>T1=293K,V1 =V2=3mL,则可通过实验B、C探究温度对化学反应速率的影响
D.利用实验B中数据计算,用KMnO4的浓度变化表示的化学反应速率v(KMnO4)=5×10-4mol·L-1·s-1