题目内容
【题目】硫、铁的化合物有广泛的应用。
(1)过二硫酸铵(NH4)2S2O8可以看成双氧水的衍生物,H2O2分子中的两个H原子被—SO3H基取代后即为过二硫酸。
①(NH4)2S2O8中硫元素的化合价为_________;
②用过二硫酸铵溶液检测废水中的Mn2+,配平下面的离子反应:
__S2O82-+__Mn2++__=___MnO4-+__SO42-+____。
(2)大苏打的成分是Na2S2O3·5H2O,常用于防毒面具中吸收氯气。若1 mol Na2S2O3完全反应,失去8mol电子。写出其水溶液吸收氯气的离子方程式______________。
(3)磁性材料A是由两种元素组成的化合物,某研究小组按如图所示流程探究其组成:
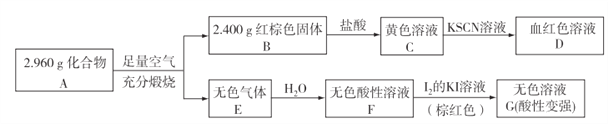
①A的化学式为____________;
②已知化合物A能与盐酸反应,生成一种淡黄色不溶物和一种气体(标准状况下密度为1.518g/L),写出该反应的离子方程式:_______________________。
【答案】 +6 5 2 8H2O 2 10 16H+ S2O32-+4Cl2+5H2O=2SO42-+8C1-+10H+ Fe3S4 Fe3S4+6H+=3H2S↑+3Fe2+ +S
【解析】(1)①根据N为-3价、氢为+1价、氧为-2价进行计算可得:(NH4)2S2O8中硫元素的化合价为+6价;反应中Mn元素化合价由Mn2+中+2价升高为MnO4-中+7价,Mn2+是还原剂,S元素化合价由S2O82-中+7价降低为SO42-中+6价,S2O82-是氧化剂,根据电子转移守恒可配得离子方程式为:5S2O82-+2Mn2++8H2O=2MnO4-+10SO42-+16H+;(2)若1 mol Na2S2O3完全反应,失去8mol电子,Na2S2O3中硫的化合价为+2,则化合价应该升为+6价,且根据得失电子守恒,反应时消耗的氯气的物质的量为4mol且生成氯离子,则其水溶液吸收氯气的离子方程式为:S2O32-+4Cl2+5H2O=2SO42-+8C1-+10H+;(3)C加入KSCN,D为血红色溶液,可知C为FeCl3,D为Fe(SCN)3等,可知B为Fe2O3,且n(Fe2O3)=![]() =0.015mol,n(Fe)=0.03mol,m(Fe)=0.03mol×56g/mol=1.68g,A燃烧生成的无色气体E溶液水得到酸性溶液,加入碘的KI溶液,得到无色溶液,说明碘可氧化E的水溶液,E应为SO2,F为H2SO3,G含有和H2SO4和HI,可知A含有Fe、S元素,且m(S)=2.96g﹣1.68g=1.28g,n(S)=
=0.015mol,n(Fe)=0.03mol,m(Fe)=0.03mol×56g/mol=1.68g,A燃烧生成的无色气体E溶液水得到酸性溶液,加入碘的KI溶液,得到无色溶液,说明碘可氧化E的水溶液,E应为SO2,F为H2SO3,G含有和H2SO4和HI,可知A含有Fe、S元素,且m(S)=2.96g﹣1.68g=1.28g,n(S)=![]() =0.04mol,可知n(Fe):n(S)=3:4,应为Fe3S4,①由以上分析可知,A组成元素为Fe、S,为Fe3S4;②化合物A能与稀硫酸反应,生成一种淡黄色不溶物和一种气体(标况下的密度为1.518gL﹣1),淡黄色不溶物为S,气体的摩尔质量为1.518 g/L×22.4L/mol=34g/mol,为H2S气体,反应的离子方程式为Fe3S4+6H+=3H2S↑+3Fe2+ +S。
=0.04mol,可知n(Fe):n(S)=3:4,应为Fe3S4,①由以上分析可知,A组成元素为Fe、S,为Fe3S4;②化合物A能与稀硫酸反应,生成一种淡黄色不溶物和一种气体(标况下的密度为1.518gL﹣1),淡黄色不溶物为S,气体的摩尔质量为1.518 g/L×22.4L/mol=34g/mol,为H2S气体,反应的离子方程式为Fe3S4+6H+=3H2S↑+3Fe2+ +S。

 名校课堂系列答案
名校课堂系列答案【题目】四个电解装置都以Pt作电极,它们分别装着如下电解质溶液进行电解,电解一段时间后,测定其pH变化,所记录的结果正确的是
选项 | A | B | C | D |
电解质溶液pH 变化 | HCl | AgNO3 | KOH | BaCl2 |
pH变化 | 减小 | 增大 | 增大 | 不变 |
A. A B. B C. C D. D