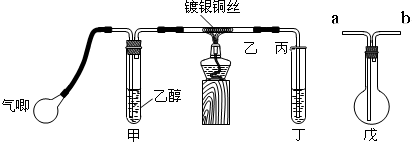
题目内容
13.向Cr2(SO4)3水溶液中,加入NaOH溶液,当pH=4.6时,开始出现Cr(OH)3沉淀,随着碱性增强,沉淀增多;但当[OH-1]大于0.1mol•L-1时,沉淀消失,出现亮绿色的亚铬酸根离子(CrO2-).平衡关系如下: ,向50mL0.05mol•L-1的Cr2(SO4)3溶液中,加入1.0mol•L-1NaOH溶液50mL,反应后观察到现象是( )
,向50mL0.05mol•L-1的Cr2(SO4)3溶液中,加入1.0mol•L-1NaOH溶液50mL,反应后观察到现象是( )| A. | .紫色 | B. | .亮绿色 | C. | 有灰绿色沉淀 | D. | .无法判断 |
分析 根据Cr3++4OH-=CrO22-+2H2O计算反应后剩余的n(OH-),进而计算c(OH-),再根据Kw=c(H+)•c(OH-)计算c(H+),最后利用pH=-lgc(H+)计算pH值进行判断.
解答 解:n(Cr3+)=0.1 mol/L×0.05 L=0.005 mol
Cr3++4OH-=CrO22-+2H2O
0.005mol 0.02 mol
剩余n(OH-)=1mol/L×0.05L-0.02 mol=0.03 mol,
使用c(OH-)=$\frac{0.03mol}{0.05L+0.05L}$=0.3 mol/L,
所以c(H+)=$\frac{1{0}^{-14}}{0.3}$mol/L=3.3×10-14 mol/L,
故pH=-lg3.3×10-14=13.5>13,所以此时溶液中主要以CrO22-形式存在,溶液显亮绿色.
故选B.
点评 本题考查有关溶液pH值的计算、根据计算判断反应等,难度中等,计算反应后的pH值是关键.

练习册系列答案
 轻巧夺冠周测月考直通名校系列答案
轻巧夺冠周测月考直通名校系列答案
相关题目
8.下列说法中错误的是( )
| A. | 保护环境就是保护人类自身 | |
| B. | 环境污染主要包括大气污染、水污染、土壤污染、食品污染等 | |
| C. | 人吸入二氧化硫,会发生呼吸道疾病 | |
| D. | 消除大气污染的根本方法是限制化学工业的发展 |
7.FeCl3在现代工业生产中应用广泛.某化学研究性学习小组模拟工业流程制备无水FeCl3,再用副产品FeCl3溶液吸收有毒的H2S.
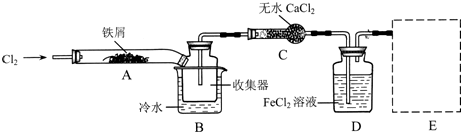
Ⅰ.经查阅资料得知:无水FeCl3在空气中易潮解,加热易升华.他们设计了制备无水FeCl3的实验方案,装置示意图(加热及夹持装置略去)及操作步骤如下:
①检验装置的气密性;
②通入干燥的Cl2,赶尽装置中的空气;
③用酒精灯在铁屑下方加热至反应完成;
④…
⑤体系冷却后,停止通入Cl2,并用干燥的N2赶尽Cl2,将收集器密封.
请回答下列问题:
(1)装置A中反应的化学方程式为2Fe+3Cl2 $\frac{\underline{\;\;△\;\;}}{\;}$2FeCl3
(2)第③步加热后,生成的烟状FeCl3大部分进入收集器,少量沉积在反应管A右端.要使沉积的FeCl3进入收集器,第④步操作是在沉积的FeCl3固体下方加热
(3)操作步骤中,为防止FeCl3潮解所采取的措施有(填步骤序号)②⑤
(4)装置B中冷水浴的作用为冷却,使FeCl3沉积,便于收集产品,装置C的名称为干燥管;装置D中FeCl2全部反应后,因失去吸收Cl2的作用而失效,写出检验FeCl2是否失效的试剂:酸性KMnO4溶液.
(5)在虚线框中画出尾气吸收装置E并注明试剂.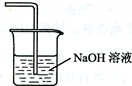
(6)用含有Al203、SiO2和少量FeO•xFe2O3的铝灰制备Al2(SO4)3•18H2O.工艺流程如下(部分操作和条件略)
Ⅰ.向铝灰中加入过量稀H2SO4,过滤
Ⅱ.向滤液中加入过量KMnO4溶液,调节溶液的pH约为3;
Ⅲ.加热,产生大量棕色沉淀,静置,上层溶液呈紫红色
Ⅳ.加入MnSO4至紫红色消失,过滤;
Ⅴ.浓缩、结晶、分离,得到产品.
已知:金属离子的起始浓度为0.1mol•L-1
根据表中数据解释步骤Ⅱ的目的:加入过量KMnO4溶液,将亚铁离子氧化为铁离子,调PH为了使铁离子完全转化为Fe(OH)3沉淀.

Ⅰ.经查阅资料得知:无水FeCl3在空气中易潮解,加热易升华.他们设计了制备无水FeCl3的实验方案,装置示意图(加热及夹持装置略去)及操作步骤如下:
①检验装置的气密性;
②通入干燥的Cl2,赶尽装置中的空气;
③用酒精灯在铁屑下方加热至反应完成;
④…
⑤体系冷却后,停止通入Cl2,并用干燥的N2赶尽Cl2,将收集器密封.
请回答下列问题:
(1)装置A中反应的化学方程式为2Fe+3Cl2 $\frac{\underline{\;\;△\;\;}}{\;}$2FeCl3
(2)第③步加热后,生成的烟状FeCl3大部分进入收集器,少量沉积在反应管A右端.要使沉积的FeCl3进入收集器,第④步操作是在沉积的FeCl3固体下方加热
(3)操作步骤中,为防止FeCl3潮解所采取的措施有(填步骤序号)②⑤
(4)装置B中冷水浴的作用为冷却,使FeCl3沉积,便于收集产品,装置C的名称为干燥管;装置D中FeCl2全部反应后,因失去吸收Cl2的作用而失效,写出检验FeCl2是否失效的试剂:酸性KMnO4溶液.
(5)在虚线框中画出尾气吸收装置E并注明试剂.

(6)用含有Al203、SiO2和少量FeO•xFe2O3的铝灰制备Al2(SO4)3•18H2O.工艺流程如下(部分操作和条件略)
Ⅰ.向铝灰中加入过量稀H2SO4,过滤
Ⅱ.向滤液中加入过量KMnO4溶液,调节溶液的pH约为3;
Ⅲ.加热,产生大量棕色沉淀,静置,上层溶液呈紫红色
Ⅳ.加入MnSO4至紫红色消失,过滤;
Ⅴ.浓缩、结晶、分离,得到产品.
已知:金属离子的起始浓度为0.1mol•L-1
| Al(OH)3 | Fe(OH)2 | Fe(OH)3 | |
| 开始沉淀时 | 3.4 | 6.3 | 1.5 |
| 完全沉淀时 | 4.7 | 8.3 | 2.8 |
4.水的沸点为100℃,硫化氢的分子结构跟水相似,但它的沸点却很低,是-60.7℃,引起这种差异的主要原因是( )
| A. | 范德华力 | B. | 共价键 | C. | 氢键 | D. | 相对分子质量 |
5.下列说法中正确的是( )
| A. | 1 L水中溶解了58.5 g NaCl,该溶液的物质的量浓度为1 mol/L | |
| B. | 从1 L 2 mol/L的H2SO4溶液中取出0.5 L,该溶液的浓度为1 mol/L | |
| C. | 配制500 mL 0.5 mol/L的CuSO4溶液,需62.5 g胆矾 | |
| D. | 中和100 mL 1 mol/L的H2SO4溶液,需NaOH 4 g |