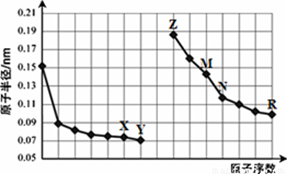
题目内容
下列比较中,正确的是
| A.CH4与SiH4的稳定性:CH4>SiH4 |
| B.HClO与H2SO4的酸性:HClO >H2SO4 |
| C.1molHCl(g)的能量比1molH2(g)和1molCl2(g)的能量和高 |
| D.Cl与S的原子半径:Cl >S |
A
试题分析:A.非金属性:C>Si;元素的非金属性越强,其对应的简单氢化物的稳定性就越强。故CH4与SiH4的稳定性:CH4>SiH4。正确。B.元素的非金属性越强,其最高价氧化物对应的水化物的酸性就越强。非金属性:Cl>S,所以酸性:HClO4>H2SO4。错误。C.H2在Cl2中燃烧的反应是放热反应。所以2molHCl(g)的能量比1molH2(g)和1molCl2(g)的能量和低。错误。D.Cl与S是同一周期的元素。元素的原子序数越大,原子半径就越小。所以相应的原子半径:S>Cl。错误。

练习册系列答案
 举一反三单元同步过关卷系列答案
举一反三单元同步过关卷系列答案
相关题目


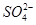 的空间构型为_________,H2O中O原子的杂化方式为____________。
的空间构型为_________,H2O中O原子的杂化方式为____________。 配离子。已知
配离子。已知 的空间构型都是三角锥形,但NF3不易与Cu2+形成配离子,其原因是____________________________。
的空间构型都是三角锥形,但NF3不易与Cu2+形成配离子,其原因是____________________________。 N形成的晶体结构如图所示,N3-的配位数是________。设晶胞边长为a cm,密度为b g/cm3,则阿伏加德罗常数可表示为___________(用含a、b的式子表示)。
N形成的晶体结构如图所示,N3-的配位数是________。设晶胞边长为a cm,密度为b g/cm3,则阿伏加德罗常数可表示为___________(用含a、b的式子表示)。