题目内容
氮的化合物在生产生活中广泛存在。
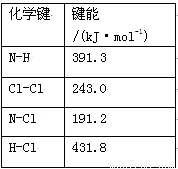
(1)①氯 胺(NH2Cl)的电子式为 。可通过反应NH3(g)+Cl2(g)=NH2Cl(g)+HCl(g)制备氯胺,已知部分化学键的键能如下表所示(假定不同物质中同种化学键的键能一样),则上述反应的ΔH= 。
胺(NH2Cl)的电子式为 。可通过反应NH3(g)+Cl2(g)=NH2Cl(g)+HCl(g)制备氯胺,已知部分化学键的键能如下表所示(假定不同物质中同种化学键的键能一样),则上述反应的ΔH= 。
②NH2Cl与水反应生成强氧化性的物质,可作长效缓释消毒剂,该反应的化学方程式为 。
(2)用焦炭还原NO的反应为:2NO(g)+C(s)  N2(g)+CO2(g),向容积均为1 L的甲、乙、丙三个恒容恒温(反应温度分别为400℃、400℃、T℃)容器中分别加入足量的焦炭和一定量的NO,测得各容器中n(NO)随反应时间t的变化情况
N2(g)+CO2(g),向容积均为1 L的甲、乙、丙三个恒容恒温(反应温度分别为400℃、400℃、T℃)容器中分别加入足量的焦炭和一定量的NO,测得各容器中n(NO)随反应时间t的变化情况 如下表所示:
如下表所示:
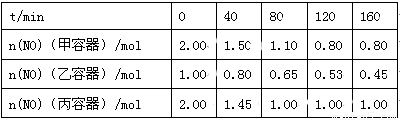
①该反应为 (填“放热”或“吸热”)反应。
②乙容器在200 min达到平衡状态,则0~200 min内用NO的浓度变化表示的平均反应速率v(NO)= 。
(3)用焦炭还原NO2的反应为:2NO2(g)+2C(s) N2(g)+2CO2(g),在恒温条件下,1 mol NO2和足量C发生该反应,测得平衡时NO2和CO2的物质的量浓度与平衡总压的关系如图所示:
N2(g)+2CO2(g),在恒温条件下,1 mol NO2和足量C发生该反应,测得平衡时NO2和CO2的物质的量浓度与平衡总压的关系如图所示:
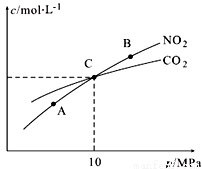
①A、B两点的浓度平衡常数关系:Kc(A) Kc(B)(填“<”或“>”或“=”)。
②A、B、C三点中NO2的转化率最高的是 (填“A”或“B”或“C”)点。
③计算C点时该反应的压强平衡常数Kp(C)= (Kp是用平衡分压代替平衡浓度计算,分压=总压×物质的量分数)。
烟气的脱硫(除SO2)技术和脱硝(除NOx)技术都是环境科学研究的热点。
(1)烟气脱硫、脱硝的环境意义是______________________;
(2)一种选择性催化脱硝(NO2)的原理为:6NO2+8NH3 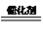 7N2+12H2O
7N2+12H2O
① 上述反应中被还原的元素是_________(填元素符号),反应中每转移3mol电子,生成标准状况下N2的体积为____________;
② 超音速飞机排放的尾气是平流层中NOx的主要来源.它们破坏臭氧层的主要机理为:
Ⅰ 、O3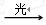 O+O2 Ⅱ 、NO+O3→NO2+O2 Ⅲ 、 NO2+O→ NO+O2
O+O2 Ⅱ 、NO+O3→NO2+O2 Ⅲ 、 NO2+O→ NO+O2
上述反应中NOx所起的作用是_____________;
(3)下表列出了2种燃煤烟气脱硫方法的原理。
方法Ⅰ | 用氨水将SO2转化为NH4HSO3,再氧化成(NH4)2SO4 |
方法Ⅱ | 用生物质热解气(主要成分CO、CH4、H2)将SO2在高温下还原成单质硫 |
①方法Ⅰ中用氨水吸收燃煤烟气中的SO2转化为NH4HSO3,是利用了SO2的___________性质(选填字母编号)。
A.漂白性 B.氧化性  C.还原性 D.酸性氧化物
C.还原性 D.酸性氧化物
②方法Ⅰ中氨水吸收燃煤烟气中SO2的化学反应为:2NH3+SO2+H2O=(NH4)2SO3
(NH4)2SO3+SO2+H2O=2NH4HSO3,能提高燃煤烟气中SO2去除率的措施有______(填字母).
A.增大氨水浓度 B.升高反应温度
C.使燃煤烟气与氨水充分接触 D.通入空气使HSO3-转化为SO42-
③采用方法Ⅰ脱硫,并不需要预先除去燃煤烟气中大量的CO2,原因是_________________(用离子方程式表示)。


 减小
减小

 B. 2N5==5N2是化学变化
B. 2N5==5N2是化学变化