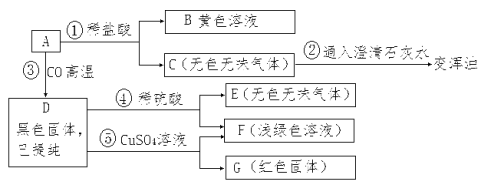
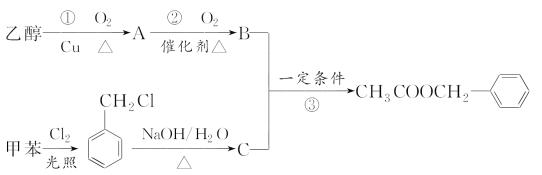
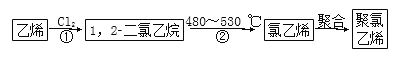题目内容
【题目】某温度时,在一个容积为2L的密闭容器中,X、Y、Z,三种物质的物质的量随时间的变化曲线如图所示.根据图中数据,试填写下列空白:
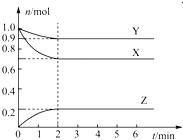
(1)该反应的化学方程式为________________________;
(2)反应开始至2min,用气体Z表示的反应速率为_____________;
(3)若X、Y、Z均为气体,反应达到平衡时:
①压强是开始时的__________倍;
②若此时将容器的体积缩小为原来的0.5倍,达到平衡时,容器内温度将升高(容器不与外界进行热交换),则该反应的正反应为__________反应(填“放热”或“吸热”).
(4)若上述反应在2min后的t1~t6内反应速率与反应时间图象如下,
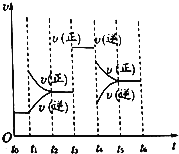
在每一时刻均改变一个影响反应速率的因素,则①t1、t3、t4时刻体系中分别改变的是什么条件?
t1:______________,t3:_______________,t4:_____________.
②下列各时间段时,Z的体积分数最高的是___________
A.t2~t3 B.t3~t4 C.t4~t5 D.t5~t6.
【答案】(1)3X+Y![]() 2Z;(2)0.05mol/(L·min);(3)①0.9;②放热;
2Z;(2)0.05mol/(L·min);(3)①0.9;②放热;
(4)①t1:增大反应物浓度,t2:加催化剂,t3:降低温度;②D。
【解析】
试题分析:(1)X、Y的物质的量减小,作反应物,Z的物质的量增大,作生成物,根据化学反应速率之比等于化学计量数之比,同时间等体积,化学计量数之比等于物质的量变化的之比,X:Y:Z=(1.0-0.7):(1.0-0.9):0.2=3:1:2,因此反应方程式为3X+Y![]() 2Z;(2)根据化学反应速率定义,v(Z)=0.2/(2×2)mol/(L·min)=0.05 mol/(L·min);(3)①同温同体积下,压强之比等于物质的量之比,反应前的物质的量为2mol,反应后气体物质的量为1.8mol,P前:P后=2:1.8=1:0.9,压强四开始时的0.9倍;②缩小容积,相当于增大压强,平衡向正反应方向进行,温度升高,说明正反应方向是放热反应;(4)①t1时刻,只增大v正,且反应方向向正反应方向进行,说明t1时刻增大的是反应物的浓度;t3时刻v正=v逆,说明使用催化剂;t4时刻,正逆反应速率都降低,可能降低温度或减小压强,当v正>v逆,说明反应向正反应方向进行,根据勒夏特列原理,应是降低温度;②Z是生成物,Z的体积分数增大,说明平衡向正反应方向进行,即D选项正确。
2Z;(2)根据化学反应速率定义,v(Z)=0.2/(2×2)mol/(L·min)=0.05 mol/(L·min);(3)①同温同体积下,压强之比等于物质的量之比,反应前的物质的量为2mol,反应后气体物质的量为1.8mol,P前:P后=2:1.8=1:0.9,压强四开始时的0.9倍;②缩小容积,相当于增大压强,平衡向正反应方向进行,温度升高,说明正反应方向是放热反应;(4)①t1时刻,只增大v正,且反应方向向正反应方向进行,说明t1时刻增大的是反应物的浓度;t3时刻v正=v逆,说明使用催化剂;t4时刻,正逆反应速率都降低,可能降低温度或减小压强,当v正>v逆,说明反应向正反应方向进行,根据勒夏特列原理,应是降低温度;②Z是生成物,Z的体积分数增大,说明平衡向正反应方向进行,即D选项正确。

 第三学期赢在暑假系列答案
第三学期赢在暑假系列答案 学练快车道快乐假期暑假作业新疆人民出版社系列答案
学练快车道快乐假期暑假作业新疆人民出版社系列答案【题目】下列实验不能达到实验目的的是( )
序号 | 实验操作 | 实验目的 |
A | Cl2、Br2分别与H2反应 | 比较氯、溴的非金属性强弱 |
B | 向MgCl2、AlCl3溶液中分别通入NH3 | 比较镁、铝的金属性强弱 |
C | 测定相同物质的量浓度的Na2CO3、Na2SO4溶液的pH | 比较碳、硫的非金属性强弱 |
D | Fe、Cu分别与稀盐酸反应 | 比较铁、铜的金属性强弱 |
A. A B. B C. C D. D