题目内容
11.绿矾(FeSO4•7H2O)是治疗缺铁性贫血药品的重要成分.下面是以市售铁屑(含少量锡、氧化铁等杂质)为原料生产纯净绿矾的一种方法: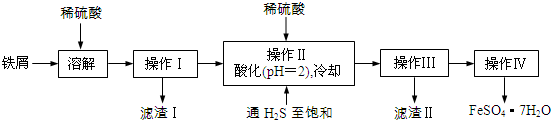
已知:室温下饱和H2S溶液的pH约为3.9,SnS沉淀完全时溶液的pH为1.6;FeS开始沉淀时溶液的pH为3.0,沉淀完全时的pH为5.5.
(1)通入硫化氢的作用是:
①除去溶液中的Sn2+离子
②除去溶液中的Fe3+,其反应的离子方程式为2Fe3++H2S=2Fe2++S↓+2H+;操作Ⅱ,在溶液中用硫酸酸化至pH=2的目的是使Sn2+沉淀完全,防止Fe2+生成沉淀.
(2)操作IV的顺序依次为:蒸发浓缩、冷却结晶、过滤、洗涤、干燥.
(3)操作IV得到的绿矾晶体用少量冰水洗涤,其目的是:①除去晶体表面附着的硫酸等杂质;②降低洗涤过程中FeSO4•7H2O的损耗.
(4)测定绿矾产品中Fe2+含量的方法是:
a.称取一定质量绿矾产品,配制成250.00mL溶液;
b.量取25.00mL待测溶液于锥形瓶中;
c.用硫酸酸化的0.01000mol/LKMnO4溶液滴定至终点,消耗KMnO4溶液体积的平均值为20.00mL.滴定时发生反应的离子方程式为:5Fe2++MnO4-+8H+=5Fe3++Mn2++4H2O).
①用硫酸酸化的0.01000mol/LKMnO4溶液滴定时,左手把握酸式滴定管的活塞,右手摇动锥形瓶,眼睛注视锥形瓶中溶液颜色的变化.
②判断此滴定实验达到终点的方法是滴加最后一滴KMnO4溶液时,溶液变成浅红色且半分钟内不褪色.
③若用上述方法测定的样品中FeSO4•7H2O的质量分数偏低(测定过程中产生的误差可忽略),其可能原因有样品中存在少量的杂质或样品部分被氧化.
分析 (1)依据三价铁离子的氧化性和硫化氢的还原性来分析,依据流程关系图分析,在H2S饱和溶液中,SnS沉淀完全时溶液的pH为1.6;FeS开始沉淀时溶液的pH为3.0,操作Ⅱ加入稀硫酸调节溶液pH=2为了除去杂质离子Sn2+;
(2)操作IV的目的是从滤液中析出绿矾晶体,利用蒸发浓缩,结晶洗涤得到晶体;
(3)操作IV得到的绿矾晶体用少量冰水洗涤目的是洗去表面杂质,温度降低绿矾溶解度降低,减少绿矾晶体的损失;
(4)①滴定操作中正确的操作方法是左手把握酸式滴定管的活塞,右手摇动锥形瓶,眼睛注视锥形瓶中溶液颜色的变化;
②当溶液里有Fe2+时,滴入的酸性高锰钾紫色溶液立即裉色,当溶液里没有Fe2+时,滴入的酸性高锰酸钾溶液紫色不褪去,结合这二种现象确定终点判断;
③因为Fe2+还原性很强,在滴定过程中也有可能被空气中的氧气氧化,另外还有可能本身样品中就含有一定的杂质.
解答 解:(1)Fe3+有强氧化性,H2S有强还原性,二者相遇要发生氧化还原反应,发生反应的离子方程式为2Fe3++H2S=2Fe2++S↓+2H+,在H2S饱和溶液中,SnS沉淀完全时溶液的pH为1.6;FeS开始沉淀时溶液的pH为3.0,沉淀完全时的pH为5.5,在溶液pH=2时,Sn2+完全沉淀,亚铁离子不沉淀,
故答案为:2Fe3++H2S=2Fe2++S↓+2H+;使Sn2+沉淀完全,防止Fe2+生成沉淀;
(2)滤液中得到晶体,需要对溶液进行加热蒸发浓缩,结晶析出,过滤洗涤等,所以操作IV的顺序依次为:蒸发浓缩、冷却结晶、过滤、洗涤、干燥,
故答案为:蒸发浓缩;冷却结晶;
(3)冰水温度低,物质溶解度减小,可以洗去沉淀表面的杂质离子,避免绿矾溶解带来的损失,
故答案为:降低洗涤过程中FeSO4•7H2O的损耗;
(4)①滴定时为准确判断滴定终点,左手把握酸式滴定管的活塞,右手摇动锥形瓶,眼睛注视锥形瓶中溶液颜色的变化,
故答案为:锥形瓶中溶液颜色的变化;
②当溶液里有Fe2+时,滴入的酸性高锰钾紫色溶液立即裉色,当酸性高锰酸钾溶液过量是溶液会显紫色,故滴加最后一滴KMnO4溶液时,溶液变成浅红色且半分钟内不褪色为滴定终点,
故答案为:滴加最后一滴KMnO4溶液时,溶液变成浅红色且半分钟内不褪色;
③用上述方法测定的样品中FeSO4•7H2O的质量分数偏低(测定过程中产生的误差可忽略),其可能原因是洗涤不彻底,亚铁离子被空气中的氧气部分氧化,
故答案为:样品中存在少量的杂质或样品部分被氧化.
点评 本题考查了铁盐亚铁盐的性质应用,分离混合物的实验方法设计和分析判断,滴定实验的分析判断,数据计算,误差分析的方法,题目难度中等.

 提分百分百检测卷单元期末测试卷系列答案
提分百分百检测卷单元期末测试卷系列答案 小学期末标准试卷系列答案
小学期末标准试卷系列答案| A. | 钠和水反应:2Na+2H2O═2Na++2OH-+H2↑ | |
| B. | 氧化钠与水反应:Na2O+H2O═2Na++2OH- | |
| C. | NaHCO3溶液与盐酸反应:CO32-+2H+═CO2↑+H2O | |
| D. | Na2CO3溶液与BaCl2溶液反应:CO32-+Ba2+═BaCO3↓ |
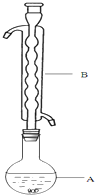 Na2S2O3俗称大苏打(海波)是重要的化工原料.用Na2SO3和硫粉在水溶液中加热反应,可以制得Na2S2O3.已知10℃和70℃时,Na2S2O3在100g水中的溶解度分别为60,.0g和212g.常温下,从溶液中析出的晶体是Na2S2O3•5H2O.现实验室欲制取Na2S2O3•5H2O晶体(Na2S2O3•5H2O的分子量为248)步骤如下:
Na2S2O3俗称大苏打(海波)是重要的化工原料.用Na2SO3和硫粉在水溶液中加热反应,可以制得Na2S2O3.已知10℃和70℃时,Na2S2O3在100g水中的溶解度分别为60,.0g和212g.常温下,从溶液中析出的晶体是Na2S2O3•5H2O.现实验室欲制取Na2S2O3•5H2O晶体(Na2S2O3•5H2O的分子量为248)步骤如下:①称取12.6g Na2SO3于烧杯中,溶于80.0mL水.
②另取4.0g硫粉,用少许乙醇润湿后,加到上述溶液中.
③(如图所示,部分装置略去),水浴加热,微沸,反应约1小时后过滤.
④滤液在经过蒸发浓缩、冷却结晶后析出Na2S2O3•5H2O晶体.
⑤进行减压过滤并干燥.
(1)仪器B的名称是球形冷凝管.其作用是冷凝回流.加入的硫粉用乙醇润湿的目的是增加反应物接触面积,提高反应速率.
(2)步骤④应采取的操作是蒸发浓缩、冷却结晶.
(3)滤液中除Na2S2O3和可能未反应完全的Na2SO3外,最可能存在的无机杂质是Na2SO4.如果滤液中该杂质的含量不很低,其检测的方法是:取出少许溶液,加稀盐酸至酸性,静置后,取上层清液或过滤除去S,再加BaCl2溶液,若出现浑浊则含Na2SO4,反之不含.
(4)为了测产品的纯度,称取7.40g 产品,配制成250mL溶液,用移液管移取25.00mL于锥形瓶中,滴加淀粉溶液作指示剂,再用浓度为0.0500mol/L 的碘水,用酸式(填“酸式”或“碱式”)滴定管来滴定(2S2O32-+I2=S4O62-+2I-),滴定结果如下:
| 滴定次数 | 滴定前读数(mL) | 滴定滴定后读数(mL) |
| 第一次 | 0.30 | 31.12 |
| 第二次 | 0.36 | 31.56 |
| 第三次 | 1.10 | 31.88 |
A(s)+2B(g)?C(g)+D(g),经反应5min后,测得C的浓度为0.3mol•L-1.则下列说法中正确的是( )
| A. | 5 min内D的平均反应速率为0.02 mol•L-1•min-1 | |
| B. | 5 min内A的平均反应速率为0.06 mol•L-1•min-1 | |
| C. | 经5 min后,向容器内再加入C,正反应速率变小 | |
| D. | 平衡状态时,生成1 mol D时同时生成1 mol A |
 一定条件下存在反应C(s)+H2O(g)═CO(g)+H2(g):向甲、乙、丙三个恒容容器中加入一定量C和H2O,各容器中温度、反应物的起始量如下表,反应过程中CO的物质的量浓度随时间变化如图所示.下列说法正确的是( )
一定条件下存在反应C(s)+H2O(g)═CO(g)+H2(g):向甲、乙、丙三个恒容容器中加入一定量C和H2O,各容器中温度、反应物的起始量如下表,反应过程中CO的物质的量浓度随时间变化如图所示.下列说法正确的是( )| 容器 | 甲 | 乙 | 丙 |
| 容积 | 0.5L | 0.5L | V |
| 温度 | T1℃ | T2℃ | T1℃ |
| 起始量 | 2molC 1molH2O | 1molCO 1molH2 | 4molC 2molH2O |
| A. | 甲容器中,反应在前15min的平均速率v(H2)=0.1 mol•L-1•min-1 | |
| B. | 丙容器的体积V>0.5L | |
| C. | 当温度为T1℃时,反应的平衡常数K=4.5 | |
| D. | 乙容器中,若平衡时n(H2O)=0.4 mol,则T1<T2 |
| A. | 向未知溶液中加入AgNO3溶液,有白色沉淀产生 | |
| B. | 向未知溶液中加入AgNO3溶液,有白色沉淀产生,加入盐酸,沉淀不消失 | |
| C. | 向未知溶液中加入稀硝酸酸化后,再加入AgNO3溶液,有白色沉淀产生 | |
| D. | 向未知溶液中加入稀盐酸酸化后,再加入AgNO3溶液,有白色沉淀产生 |
| A. | 该合金中铜与镁的质量之比是16:3 | |
| B. | 该浓硝酸中HNO3的物质的量浓度是14.0 mol•L-1 | |
| C. | NO2和N2O4的混合气体中,N2O4的体积分数是80% | |
| D. | 反应中转移电子的物质的量为0.06mol |

 .
.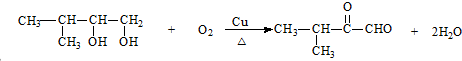 ;F→G:
;F→G: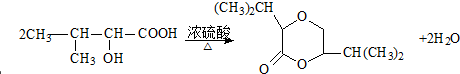 .
.