题目内容
【题目】在一体积为1 L的容器中,通入一定量的N2 O4,在100℃时发生如下反应: N2O4(g)![]() NO2(g)ΔH>0,其N2O4和NO2浓度变化如图。
NO2(g)ΔH>0,其N2O4和NO2浓度变化如图。
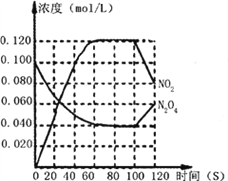
(1)在0-60s这段时间内,以N2O4表示的平均反应速率为_______mol·L-1·s-1
(2)上述反应的平衡常数表达式为______,升高温度K值______ (填“增大"、“减小”或“不变”)
(3)反应进行到100s时,若有一项条件发生变化,变化的条件不可能是______ (填选项序号)。
A.降低温度 B.通人氦气使其压强增大 C.又往容器中充入N2O4 D.使用催化剂
【答案】 0.001 ![]() 增大 BCD
增大 BCD
【解析】(1)![]() mol·L-1·s-1
mol·L-1·s-1
(2)由平衡常数的概念可知:K=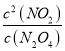 ;由于△H>0,升温平衡正向移动,K增大
;由于△H>0,升温平衡正向移动,K增大
(3)由图像可知, ![]() 逐渐减小,而
逐渐减小,而![]() 逐渐增大,平衡左移,故:
逐渐增大,平衡左移,故:
A:降温平衡左移,与图像相符
B:恒容下通入氩气,各物质浓度不变,正逆反应速度不变,平衡不发生移动,与图像不符
C:又往容器中充入N2O4, ![]() 瞬间增大,与图像不符
瞬间增大,与图像不符
D:使用催化剂,不影响平衡移动,各物质浓度不变,与图像不符
故BCD符合题意

 中考解读考点精练系列答案
中考解读考点精练系列答案【题目】已知几种难溶电解质的溶度积如下表所示:
几种难溶电解质的Ksp(25℃) | |
沉淀溶解平衡 | Ksp |
AgBr(s) | 5,0×10-13 mol2·L-2 |
AgI(s) | 8.3×10-17 mol2·L-2 |
FeS(s) | 6.3×10-18 mol2·L-2 |
ZnS(s) | 1.6×10-24 mol2·L-2 |
CuS(s) | 1.3×10-36 mol2·L-2 |
(1)AgBr、AgI、FeS、ZnS、CuS的溶解能力由大到小的顺为:____________________。
(2)向饱和的AgI溶液中加入固体硝酸银,则c( I- )________(填“增大”、“减小”或“不变”),若改加AgBr固体,则c(Ag+)__________(填“增大”、“减小”或“不变”)。
(3)在25℃时,向100mL浓度均为0.1 mol·L-1 FeCl2、ZnCl2、CuCl2的混合溶液中逐滴加入Na2S溶液,生成的沉淀的先后顺序是_____________________(用沉淀物的化学式表示)。
(4)在25℃时,把ZnS加入蒸馏水中,一定时间后达到如下平衡: ZnS(s)![]() Zn2+(aq)+S2-(aq),下列措施可使ZnS减少的是 _______。
Zn2+(aq)+S2-(aq),下列措施可使ZnS减少的是 _______。
A.加入少量CuS固体 B.加入少量FeS固体
C.加入少量FeCl2固体 D.加入少量CuCl2固体