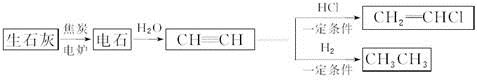
题目内容
以色列科学家达尼埃尔·谢赫特曼因发现“准晶体”而独享2011年诺贝尔化学奖以及奖金。现在,准晶体已在很多应用领域“大展拳脚”,可用来制造不粘锅、发光二极管、热电转化设备等。
(1)铁在周期表中的位置 ,铝的原子结构示意图为 ;
(2)工业炼铝用的原料是 (填Al2O3或AlCl3),不用另一种的原因是
;
(3)铜在潮湿的空气中会生成铜绿,写出该反应方程式
;
(4)用电解法制Fe(OH)2沉淀,下列可做电解质溶液的是
| A.纯净水 | B.NaCl溶液 | C.NaOH溶液 | D.CuCl2溶液 |
(1)第四周期Ⅷ族 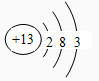
(2)Al2O3 AlCl3是共价化合物,在熔融状态下不导电
(3)2Cu + CO2 + O2 + H2O = Cu2(OH)2CO3
(4)B C
解析试题分析:(1)Fe在元素周期表中位于第四周期、第Ⅷ族;Al的原子结构示意图是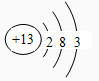 ;
;
(2)工业炼铝用的原料是Al2O3不是AlCl3,因为AlCl3是共价化合物,在熔融状态下不导电
(3)铜绿的成分是Cu2(OH)2CO3,是Cu与空气中的氧气、水、二氧化碳反应的产物,化学方程式为
2Cu + CO2 + O2 + H2O = Cu2(OH)2CO3
(4)A、纯净水的离子浓度较小,不适宜做电解质溶液,错误;B、NaCl溶液作电解质溶液,阳极是Fe放电,阴极是H+放电,能生成Fe(OH)2沉淀,正确;C、氢氧化钠溶液作电解质溶液,阳极是Fe放电,阴极是氢离子放电,能生成Fe(OH)2沉淀,正确;D、氯化铜作电解质溶液,阳极是Fe放电,阴极是铜离子放电,溶液的OH-离子浓度不变,不能生成Fe(OH)2沉淀,错误,答案选BC。
考点:考查工业制铝的方法,元素的位置及原子结构示意图的书写,铜绿的生成,电解质溶液的选择

 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案X、Y、Z、W是元素周期表前四周期中的常见元素,其相关信息如下表:
| 元素 | 相关信息 |
| X | X的某种氢化物能使湿润的红色石蕊试纸变蓝 |
| Y | 单质是良好的半导体材料,广泛应用于光电信息领域 |
| Z | Z的一种核素质量数为27,中子数为14 |
| W | 最高价氧化物对应的水化物是一种不溶于水的蓝色固体 |
(1)Z位于元素周期表第 周期第 族,W基态原子的核外电子排布式为
(2)X的第一电离能比Y的 (填“大”或“小”),X的单质分子中σ键和π键的数目比为 ,Y氧化物属于 晶体。
(3)X的氢化物(X2H4)的制备方法之一是将NaC1O溶液和XH3反应制得,试写出该反应的化学方程式 。
(4)己知下列数据:
4W(s)+O2(g)=2W2O(s) △H=一337.2kJ·mol—1
2W(s)+O2(g)=2WO(s) △H=一314.6kJ·mol—1
由W2O和O2反应生成WO的热化学方程式是 。
下列是三个不同短周期部分元素的原子半径及主要化合价:
| 元素代号 | W | R | X | Y | Z |
| 原子半径/nm | 0.037 | 0.154 | 0.066 | 0.070 | 0.077 |
| 主要化合价 | +1 | +1 | -2 | -3、+5 | +2、+4 |
试回答下列问题:
(1)五种元素中原子半径最大的元素是 (填元素符号),画出该元素的原子结构示意图: 。
(2)W、X和Y可组成一化合物,其原子个数比为4:3:2,则该化合物属 (填“离子化合物”或“共价化合物”),存在的化学键是 。写出该化合物与由W、R和X按原子个数比为1:1:1组成化合物反应的化学方程式:
。
(3)写出下列反应的化学方程式:
Z的单质与Y元素的最高价氧化物对应的水化物反应: 。
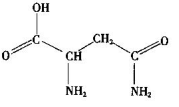
(13分)有A、B、C、D、E、R六种短周期元素,其元素特征信息如下表:
| 元素编号 | 元素特征信息 |
| A | 其单质是密度最小的物质 |
| B | 其阴离子带两个单位的负电荷,单质是空气主要成分之一 |
| C | 其阳离子与B的阴离子具有相同的电子层结构,其原子的最外层电子数是次外层的1/4 |
| D | 其氢氧化物和氧化物都有两性,且与C同周期 |
| E | 与C同周期,其原子半径在该周期最小 |
| R | 有多种化合价,其最高正价为+6价 |
(1)写出下列元素的名称:C ,E ;画出B的阴离子结构示意图: 。
(2)B、C、D的简单离子半径由大到小的顺序是 (用化学式表示)。E元素的最高价含氧酸的化学式是 ;
(3)实验证明D的氢氧化物(或氧化物)具有两性的操作方法是: 。
(4)在一定条件下,RO32-与R2-可发生反应:RO32-+2R2-+6H+ = 3R+3H2O,下列有关叙述中,正确的是 (填序号)。
A.元素R位于周期表中第3 周期,ⅥA族
B.R2-与氖原子电子层结构相同
C.RO32-在它能发生的所有反应中都只具有氧化性
D.反应中消耗1 mol RO32- ,转移的电子的物质的量为4 mol
(5)请写出涉及上述元素间的两个反应的离子方程式,要求:(1)单质之间的置换 (2)在方程式中如为两种非金属则必须是不同主族的。 ; 。
C、Si、Ge、Sn是同族元素,该族元素单质及其化合物在材料、医药等方面有重要应用.请回答下列问题:
(1)32号元素Ge的原子核外电子排布式为 ;
(2)C、Si、Sn三种元素的单质中,能够形成金属晶体的是 ;
(3)已知SnO2是离子晶体,写出其主要物理性质 ;(写出2条即可)
(4)已知:
| | CH4 | SiH4 | NH3 | PH3 |
| 沸点(K) | 101.7 | 161.2 | 239.7 | 185.4 |
| 分解温度(K) | 873 | 773 | 1073 | 713.2 |
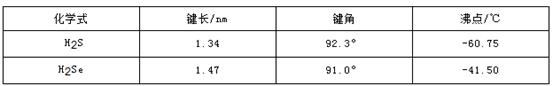
①CH4和SiH4比较,NH3和PH3比较,沸点高低的原因是 ;
②CH4和SiH4比较,NH3和PH3比较,分解温度高低的原因是 ;
结合上述数据和规律判断,一定压强下HF和HCl的混合气体降温时 ;
(5))用价层电子对互斥理论推断SnBr2分子中Sn—Br的键角 120°(填“>”“<”或“=”)。
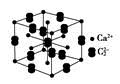
(6)铅、钡、氧形成的某化合物的晶胞结构是:Pb4+处于立方晶胞顶点,Ba2+处于晶胞中心,O2-处于晶胞棱边中心,该化合物化学式为 ,每个Ba2+与 个O2-配位。