题目内容
【题目】I.在恒温条件下将一定量X和Y的混合气体通入一容积为2L的密闭容器中,X和Y两物质的浓度随时间变化情况如图。

(1)该反应的化学方程式为 (反应物或生成物用符号X、Y表示): _________________。
(2)a、b、c、d四个点中,表示化学反应处于平衡状态的点是________________。
Ⅱ.(3)如图是可逆反应X2+3Y2 ![]() 2Z在反应过程中的反应速率(v)与时间(t)的关系曲线,下列叙述正确的是______。
2Z在反应过程中的反应速率(v)与时间(t)的关系曲线,下列叙述正确的是______。
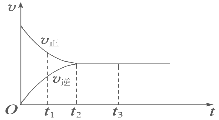
A. t1时,只有正方向反应
B. t2时,反应达到限度
C. t2~t3,反应不再发生
D. t2~t3,各物质的浓度不再发生变化
Ⅲ. 以下是关于化学反应2SO2+O2![]() 2SO3的两个素材:
2SO3的两个素材:
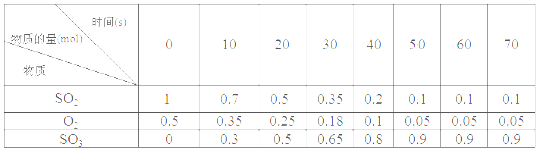
素材1:某温度和压强下,2L容器中,不同时间点测得密闭体系中三种物质的物质的量
素材2:反应在不同条件下进行时SO2的转化率:(SO2的转化率是反应的SO2占起始SO2的百分数,SO2的转化率越大,化学反应的限度越大)

根据以上的两个素材回答问题:
(4)根据素材1中计算20~30 s期间,用二氧化硫表示的化学反应平均速率为________。
(5)根据素材2中分析得到,提高该化学反应限度的途径有_______________。
(6)根据素材1、素材2中分析得到,要实现素材1中SO2的转化率需控制的反应具体条件是__________________。
【答案】Y![]() 2XbdBD0.007 5 mol·L-1·s-1增大压强或在一定范围内降低温度温度为600℃,压强为1 MPa
2XbdBD0.007 5 mol·L-1·s-1增大压强或在一定范围内降低温度温度为600℃,压强为1 MPa
【解析】
I.(1).由图可知,X的物质的量增加,Y的物质的量减少,则X为生成物,Y为反应物,由10mim达到平衡可知X、Y的物质的量的变化量,再根据物质的量的变化量之比等于化学计量数之比书写化学方程式;(2).X和Y的物质的浓度不发生变化时表示可逆反应处于平衡状态;
II.(3). 由图可知,反应从正反应方向开始,在t2之前正反应速率大于逆反应速率,t2时反应到达限度,在t2之后化学反应处于动态平衡中,各物质的浓度不再变化;
III.(4).根据20~30s内二氧化硫物质的量的变化及v=![]() 来计算;(5).根据素材2可知,增大压强、降低温度时有利于提高该化学反应的限度;(6).根据素材1计算二氧化硫的转化率,利用素材2确定合适的温度、压强。
来计算;(5).根据素材2可知,增大压强、降低温度时有利于提高该化学反应的限度;(6).根据素材1计算二氧化硫的转化率,利用素材2确定合适的温度、压强。
I.(1).由图可知,在10min之前,X的物质的量增加,Y的物质的量减少,则X为生成物,Y为反应物,由10mim达到平衡时可知Y和X的物质的量的变化量之比为:△n(Y):△n(X)=(0.6-0.4)mol:(0.6-0.2)mol=1:2,Y 和X的物质的量变化量之比等于化学计量数之比,则化学方程式为Y![]() 2X,故答案为:Y
2X,故答案为:Y![]() 2X;
2X;
(2).由图可知,10~25min及30~40min X、Y的物质的量不发生变化,则相应时间段内的点处于化学平衡状态,即b、d点处于化学平衡状态,故答案为:bd;
II.(3)A. t1时,正逆反应都发生,且正反应速率大于逆反应速率,故A错误;
B. t2时,正逆反应速率相等,则反应到达限度,故B正确;
C. t2~t3,正逆反应速率相等,化学反应达到动态平衡,正逆反应仍然发生,故C错误;
D. t2~t3,正逆反应速率相等,为化学平衡状态,各物质的浓度不再发生变化,故D正确,答案为:BD;
III.(4).由素材1可知,20~30s内二氧化硫物质的量的变化量为△n(SO2)=0.5mol-0.35mol=0.15mol,则用二氧化硫表示的化学反应平均速率为v(SO2)=![]() =0.0075 mol·L-1·s-1,故答案为:0.0075 mol·L-1·s-1;
=0.0075 mol·L-1·s-1,故答案为:0.0075 mol·L-1·s-1;
(5).由素材2可知,压强越大、温度越低时,越有利于提高该化学反应的限度,但温度太低时反应速率较慢,所以提高该化学反应限度的途径有增大压强或在一定范围内降低温度,故答案为:增大压强或在一定范围内降低温度;
(6).由素材1可知,50s时反应达到平衡,则二氧化硫的转化率为:![]() ×100%=90%,结合素材2可知,转化率为90%时温度为600℃,压强为1MPa,故答案为:温度为600℃,压强为1MPa。
×100%=90%,结合素材2可知,转化率为90%时温度为600℃,压强为1MPa,故答案为:温度为600℃,压强为1MPa。

 发散思维新课堂系列答案
发散思维新课堂系列答案【题目】1869年俄国化学家门捷列夫制出第一张元素周期表,到现在形成的周期表经过了众多化学家的艰辛努力,历经150年。元素周期表体现了元素位、构、性的关系,揭示了元素间的内在联系。下表是元素周期表的一部分,针对表中的①~⑩中元素,用元素符号或化学式填空回答以下问题:
主族 周期 | IA | IIA | IIIA | IVA | VA | VIA | VIIA | 0 |
2 | ① | ② | ||||||
3 | ③ | ④ | ⑤ | ⑥ | ⑦ | ⑧ | ⑨ | |
4 | ⑩ |
(1)表中化学性质最不活泼的元素,其原子结构示意图为___;
(2)元素①的单质电子式为____。
(3)比较③、⑤元素的金属性强弱___>___;并写出它们最高价氧化物对应的水化物间反应的化学方程式____。
(4)上述元素的最高价氧化物对应的水化物中,酸性最强的是____。
(5)在元素③、④、⑤、⑦、⑧形成的简单离子中,半径最小的是_____;
(6)工业制取⑥的单质的反应的化学方程式为_______。
【题目】Ⅰ.某研究性学习组利用H2C2O4溶液和酸性KMnO4溶液之间的反应来探究“外界条件改变对化学反应速率的影响”,实验如下:
实验序号 | 实验温度 | KMnO4溶液 | H2C2O4溶液 | H2O | 溶液褪色时间 | ||
V(mL) | C(mol/L) | V(mL) | C(mol/L) | V(mL) | t(s) | ||
A | 293K | 2 | 0.02 | 4 | 0.1 | 0 | t1 |
B | T1 | 2 | 0.02 | 3 | 0.1 | V1 | 8 |
C | 313K | 2 | 0.02 | V2 | 0.1 | 1 | t2 |
(1)通过实验A、B,可探究出_______的改变对反应速率的影响,其中V1=_____,T1=_____,通过实验_______可探究出温度变化对化学反应速率的影响。
(2)若t1<8,则由实验A、B可以得出的结论是________________________span>;利用实验B中数据计算,从反应开始到有结束,用KMnO4的浓度变化表示的反应速率为____________。
(3)该反应中有无色无味气体产生,且锰被还原为Mn2+,写出相应反应的离子方程式_______。
(4)该小组的一位同学通过查阅资料发现:反应一段时间后该反应速率会加快,造成此种变化的原因是反应体系中的某种粒子对KMnO4与H2C2O4之间的反应有某种特殊的作用,则该作用是_______________,相应的粒子最有可能是(填符号)_______。
II.100kPa时,反应2NO(g)+O2(g)![]() 2NO2(g)中NO的平衡转化率与温度的关系曲线如图1,反应2NO2(g)
2NO2(g)中NO的平衡转化率与温度的关系曲线如图1,反应2NO2(g)![]() N2O4(g)中NO2的平衡转化率与温度的关系曲线如图2。
N2O4(g)中NO2的平衡转化率与温度的关系曲线如图2。
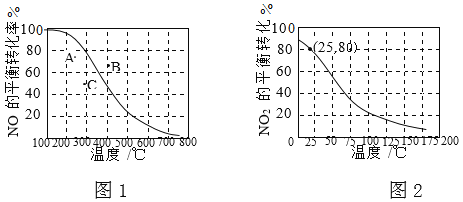
① 图1中A、B、C三点表示不同温度、压强下2NO(g)+O2(g)![]() 2NO2(g)达到平衡时NO的转化率,则________点对应的压强最大。
2NO2(g)达到平衡时NO的转化率,则________点对应的压强最大。
② 100kPa、25℃时,2NO2(g)![]() N2O4(g)平衡体系中,列式计算平衡常数Kp=________。(Kp用平衡分压代替平衡浓度计算,分压=总压×物质的量分数)
N2O4(g)平衡体系中,列式计算平衡常数Kp=________。(Kp用平衡分压代替平衡浓度计算,分压=总压×物质的量分数)