题目内容
【题目】下表是元素周期表的一部分,回答下列有关问题:
族 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅧA | 0 |
2 | ① | ② | ||||||
3 | ③ | ④ | ⑤ | ⑥ | ⑦ | ⑧ | ⑨ | |
4 | ⑩ |
(1)写出下列元素符号:① , ⑥ , ⑦ .
(2)画出原子的结构示意图:④ , ⑧ .
(3)在上述标出元素中,金属性最强的元素是 , 非金属性最强的元素是_ , 最不活泼的元素是 . (均填元素符号
(4)元素⑦与元素⑧相比,非金属性较强的是(用元素符号表示),下列表述中能证明这一事实的是 . (选填序号) a.常温下⑦的单质和⑧的单质状态不同
b.⑧的氢化物比⑦的氢化物稳定
c.一定条件下⑦和⑧的单质都能与氢氧化钠溶液反应
(5)第三周期中原子半径最大的元素是(填元素符号),跟它同周期原子半径(除稀有气体外)最小的元素是(填元素符号)它们最高价氧化物对应水化物之间反应的离子方程式
(6)已知某元素原子最外层电子数是其次外层电子数的2倍,足量该元素的常见氧化物通入③的最高价氧化物的水化物的溶液中,写出化学方程式: .
【答案】
(1)N;Si;S
(2)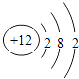 ;
;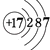
(3)K;F;Ar
(4)Cl;b
(5)Na;Cl;OH﹣+H+═H2O
(6)CO2+NaOH═NaHCO3
【解析】解:由元素在周期表中的位置可知,①为N,②为F,③为Na,④为Mg,⑤为Al,⑥为Si,⑦为S,⑧为Cl,⑨为Ar,⑩为K,为Ca,为Br,(1)由上述分析可知①为N,⑥为Si,⑦为S,所以答案是:N;Si;S;(2)④Mg的原子结构示意图为 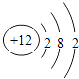 ,⑧的原子结构示意图为
,⑧的原子结构示意图为 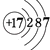 , 所以答案是:
, 所以答案是: 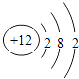 ;
; 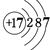 ;(3)以上元素中金属性最强的是K,非金属性最强的是F,Ar的最外层电子数为8,则Ar最不活泼,所以答案是:K;F;Ar;(4)⑦为S,⑧为Cl,同周期元素从左向右元素的非金属增强,则Cl的非金属性强,可利用气态氢化物的稳定性来验证,二者的状态及与碱的反应不能说明,
;(3)以上元素中金属性最强的是K,非金属性最强的是F,Ar的最外层电子数为8,则Ar最不活泼,所以答案是:K;F;Ar;(4)⑦为S,⑧为Cl,同周期元素从左向右元素的非金属增强,则Cl的非金属性强,可利用气态氢化物的稳定性来验证,二者的状态及与碱的反应不能说明,
所以答案是:Cl;b;(5)第三周期从左向右原子半径在减小,则Na的原子半径最大,原子半径最小的为Cl,它们最高价氧化物对应水化物之间反应的离子方程式为OH﹣+H+═H2O,所以答案是:Na;Cl;OH﹣+H+═H2O;(6)某元素原子最外层电子数是其次外层电子数的2倍,为C元素,足量该元素的常见氧化物二氧化碳通入③的最高价氧化物的水化物NaOH的溶液中的化学反应方程式为CO2+NaOH═NaHCO3 , 所以答案是:CO2+NaOH═NaHCO3 .

 巧学巧练系列答案
巧学巧练系列答案 课课练江苏系列答案
课课练江苏系列答案【题目】科学家在利用无土栽培法培养一些名贵花卉时,培养液中添加了多种必需化学元素。其配方如下:其中花卉根细胞吸收最少的离子是:
离子 | K+ | Na+ | Mg2+ | Ca2+ | NO3- | H2PO4- | SO42- | Zn2+ |
培养液浓度(mmol/L) | 1 | 1 | 0.25 | 1 | 2 | 1 | 0.25 | 1 |
A. Ca2+ B. SO42- C. Zn2+ D. H2PO4-
【题目】已知X、Y是短周期的两种元素,下列有关比较或说法中一定正确的是( )
选项 | 条件 | 结论 |
A | 若原子半径:X>Y | 原子序数:X<Y |
B | 化合物XnYm中X显负价 | 元素的电负性:X>Y |
C | 若价电子数:X>Y | 最高正价:X>Y |
D | 若X、Y最外层电子数分别为1、7 | X、Y之间一定能形成离子键 |
A.AB.BC.CD.D