题目内容
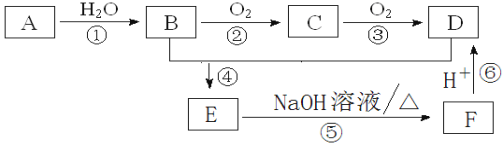
【题目】下图是工业上铝土矿(含有Al2O3和Fe2O3等)冶炼铝的工艺流程图:
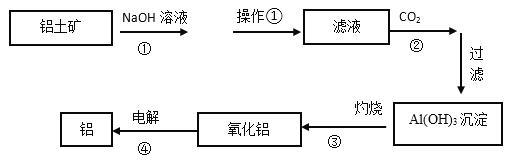
(1)操作①的名称是:_________。操作①剩余的矿渣主要成分为:__________(填化学式)。
(2)图中①的离子方程式___________________________;④的化学反应方程式___________。
(3)洗涤Al(OH)3沉淀的具体操作是: ________________________________________。
【答案】过滤 Fe2O3 Al2O3+2OH-=2AlO2-+H2O 2Al2O3(熔融)![]() 4Al+3O2↑ 往漏斗中加水至浸没沉淀,待水自然流下,重复操作2-3次
4Al+3O2↑ 往漏斗中加水至浸没沉淀,待水自然流下,重复操作2-3次
【解析】
Al2O3、Fe2O3都和硫酸反应,要将氧化铝和Fe2O3分离出来,应该选择氢氧化钠,将氧化铝溶解为偏铝酸钠,剩余固体难溶物氧化铁,操作①是过滤,沉淀中含有氧化铁,滤液是偏铝酸钠溶液,偏铝酸钠中通二氧化碳来获得氢氧化铝沉淀,发生CO2+AlO2-+2H2O=Al(OH)3↓+HCO3-,过滤,氢氧化铝沉淀加热分解生成氧化铝,电解可得铝,以此解答该题。
(1)根据以上分析操作①是用来分离Fe2O3和偏铝酸钠溶液,固液分离应该选择过滤,操作①剩余的矿渣主要成分为Fe2O3;
答案:过滤 Fe2O3
(2)图中①Al2O3与氢氧化钠反应的离子方程式Al2O3+2OH-=2AlO2-+H2O;反应④电解熔融的氧化铝用来冶炼铝,化学反应方程式2Al2O3(熔融)![]() 4Al+3O2↑;
4Al+3O2↑;
答案:Al2O3+2OH-=2AlO2-+H2O 2Al2O3(熔融)![]() 4Al+3O2↑
4Al+3O2↑
(3)洗涤沉淀通常采用淋洗法,即往漏斗中加水至浸没沉淀,待水自然流下,重复操作2-3次;
答案:往漏斗中加水至浸没沉淀,待水自然流下,重复操作2-3次

 全能练考卷系列答案
全能练考卷系列答案 一课一练课时达标系列答案
一课一练课时达标系列答案【题目】有X、Y、Z、W、Q五种短周期元素在周期表中的相对位置如下所示,其中Z原子的核外电子数是其价电子数的3倍,Q的一种核素没有中子。
X | Y | |
Z | W |
请回答下列问题:
(1)元素W在元素周期表中的位置是___________________________;
(2)画出Z的原子结构示意图______________;QXY的电子式为_________________;
(3)Y的最高价氧化物的化学式为_________;
(4)W和Y形成的一种二元化合物具有色温效应,其相对分子质量在170~190之间,且W的质量分数约为70%。该化合物的化学式为_________________;
(5) (XY)2称为拟卤素,性质与卤素类似,其与氢氧化钠溶液反应的化学方程式为________。