题目内容
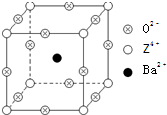 (2011?江西二模)已知X、Y和Z三种元素的原子序数之和等于48.X的一种1:1型氢化物分子中既有σ键又有π键.Z是金属元素,Z的单质和化合物有广泛的用途.已知Z的核电荷数小于28,且次外层有2个未成对电子.工业上利用ZO2和碳酸钡在熔融状态下制取化合物M(M可看做一种含氧酸盐).M有显著的“压电性能”,应用于超声波的发生装置.经X射线分析,M晶体的最小重复单位为正方体(如图),边长为4.03×10-10m,顶点位置为Z4+所占,体心位置为Ba2+所占,所有棱心位置为O2-所占.
(2011?江西二模)已知X、Y和Z三种元素的原子序数之和等于48.X的一种1:1型氢化物分子中既有σ键又有π键.Z是金属元素,Z的单质和化合物有广泛的用途.已知Z的核电荷数小于28,且次外层有2个未成对电子.工业上利用ZO2和碳酸钡在熔融状态下制取化合物M(M可看做一种含氧酸盐).M有显著的“压电性能”,应用于超声波的发生装置.经X射线分析,M晶体的最小重复单位为正方体(如图),边长为4.03×10-10m,顶点位置为Z4+所占,体心位置为Ba2+所占,所有棱心位置为O2-所占.(1)Y在周期表中位于
第四周期第ⅡA族
第四周期第ⅡA族
;Z4+的核外电子排布式为1s22s22p63s23p6
1s22s22p63s23p6
;(2)X的该种氢化物分子构型为
直线型
直线型
,X在该氢化物中以sp
sp
方式杂化.X和Y形成的化合物的熔点应该高于
高于
(填“高于”或“低于”)X氢化物的熔点.(3)①制备M的化学反应方程式是
TiO2+BaCO3═BaTiO3+CO2↑
TiO2+BaCO3═BaTiO3+CO2↑
;②在M晶体中,若将Z4+置于立方体的体心,Ba2+置于立方体的顶点,则O2-处于立方体的
面心
面心
;③在M晶体中,Z4+的氧配位数为
6
6
;④已知O2-半径为1.40×10-10 m,则Z4+半径为
6.15×10-11
6.15×10-11
m.分析:因为Z的核电荷数小于28,且次外层有2个未成对电子,Z应是Ti,原子序数为22,X的一种1:1型氢化物分子中既有σ键又有π键,应为H-C≡C-H,则X为C元素,X、Y和Z三种元素的原子序数之和等于48,则Y的原子序数为20,应为Ca元素,
(1)根据原子核外电子排布特点判断元素在周期表中的位置;根据能量最低原理书写电子排布式;
(2)X的氢化物为H-C≡C-H,根据结构和成键特点判断空间构型和杂化类型;
(3)①根据反应物和生成物结合质量守恒定律书写化学方程式;
②在M晶体中,若将Z4+置于立方体的体心,Ba2+置于立方体的顶点,则O2-处于立方体的面心;
③根据晶胞的结构判断;
④根据晶胞可知,O2-和Z4+的直径之和为4.03×10-10m.
(1)根据原子核外电子排布特点判断元素在周期表中的位置;根据能量最低原理书写电子排布式;
(2)X的氢化物为H-C≡C-H,根据结构和成键特点判断空间构型和杂化类型;
(3)①根据反应物和生成物结合质量守恒定律书写化学方程式;
②在M晶体中,若将Z4+置于立方体的体心,Ba2+置于立方体的顶点,则O2-处于立方体的面心;
③根据晶胞的结构判断;
④根据晶胞可知,O2-和Z4+的直径之和为4.03×10-10m.
解答:解:(1)Y为Ca元素,原子序数为20,原子核外有4个电子层,最外层电子数为2,则应位于周期表第四周期、第ⅡA族,Z为Ti,离子的核外电子排布式为1s22s22p63s23p6,
故答案为:第四周期、第ⅡA族;1s22s22p63s23p6;
(2)X为C,对应的氢化物为乙炔,为直线形分子,C形成2个δ键,为sp杂化,X和Y形成的化合物为CaC2,为离子晶体,熔点高于分子晶体,故答案为:直线型;sp;高于;
(3)①由题意知M为BaTiO3,反应的化学方程式为TiO2+BaCO3═BaTiO3+CO2↑,
故答案为:TiO2+BaCO3═BaTiO3+CO2↑;
②在BaTiO3晶体中,若将Ti4+置于立方体的体心,Ba2+置于立方体的顶点,则O2-只能处于立方体的面心,
故答案为:面心;
③由BaTiO3晶胞可知,每个Ti4+周围有6个O2-,所以Ti4+的氧配位数为为6,
故答案为:6;
④设Ti4+的半径为r,则有2×1.40×10-10m+2r=4.03×10-10m,则r=6.15×10-11m,
故答案为:6.15×10-11.
故答案为:第四周期、第ⅡA族;1s22s22p63s23p6;
(2)X为C,对应的氢化物为乙炔,为直线形分子,C形成2个δ键,为sp杂化,X和Y形成的化合物为CaC2,为离子晶体,熔点高于分子晶体,故答案为:直线型;sp;高于;
(3)①由题意知M为BaTiO3,反应的化学方程式为TiO2+BaCO3═BaTiO3+CO2↑,
故答案为:TiO2+BaCO3═BaTiO3+CO2↑;
②在BaTiO3晶体中,若将Ti4+置于立方体的体心,Ba2+置于立方体的顶点,则O2-只能处于立方体的面心,
故答案为:面心;
③由BaTiO3晶胞可知,每个Ti4+周围有6个O2-,所以Ti4+的氧配位数为为6,
故答案为:6;
④设Ti4+的半径为r,则有2×1.40×10-10m+2r=4.03×10-10m,则r=6.15×10-11m,
故答案为:6.15×10-11.
点评:本题考查物质结构与性质知识,题目难度较大,本题注意把握电子排布式的书写,晶胞的计算和分析为该题的难点,学习中注意空间结构的分析,最后一问根据原子直径之和等于边长计算即可.

练习册系列答案
 金博士一点全通系列答案
金博士一点全通系列答案
相关题目
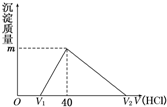 (2011?江西二模)将一定量的钠铝合金置于水中,合金全部溶解,得到20mL OH-浓度为1mol/L的溶液,然后用1mol/L的盐酸滴定,沉淀质量与消耗盐酸的体积关系如图所示,则下列选项正确的是( )
(2011?江西二模)将一定量的钠铝合金置于水中,合金全部溶解,得到20mL OH-浓度为1mol/L的溶液,然后用1mol/L的盐酸滴定,沉淀质量与消耗盐酸的体积关系如图所示,则下列选项正确的是( )