题目内容
0.1 mol/L K2CO3溶液中,若使c(CO32-)更接近0.1 mol/L,可采取的措施是
- A.加入少量盐酸
- B.加KOH固体
- C.加水
- D.加热
B
试题分析:碳酸钾溶于水存在水解平衡,即CO32-+H2O HCO3-+OH-、HCO3-+H2O
HCO3-+OH-、HCO3-+H2O H2CO3+OH-。所以要使c(CO32-)更接近0.1 mol/L,则必须抑制碳酸钾的水解,选项A、C、D都是促进水解的,氢氧化钾溶于水显碱性,抑制碳酸钾的水解,答案选B。
H2CO3+OH-。所以要使c(CO32-)更接近0.1 mol/L,则必须抑制碳酸钾的水解,选项A、C、D都是促进水解的,氢氧化钾溶于水显碱性,抑制碳酸钾的水解,答案选B。
考点:考查外界条件对盐类水解的影响。
点评:外界条件对盐类水解的影响,主要是依据勒夏特列原理进行判断。
试题分析:碳酸钾溶于水存在水解平衡,即CO32-+H2O
 HCO3-+OH-、HCO3-+H2O
HCO3-+OH-、HCO3-+H2O H2CO3+OH-。所以要使c(CO32-)更接近0.1 mol/L,则必须抑制碳酸钾的水解,选项A、C、D都是促进水解的,氢氧化钾溶于水显碱性,抑制碳酸钾的水解,答案选B。
H2CO3+OH-。所以要使c(CO32-)更接近0.1 mol/L,则必须抑制碳酸钾的水解,选项A、C、D都是促进水解的,氢氧化钾溶于水显碱性,抑制碳酸钾的水解,答案选B。考点:考查外界条件对盐类水解的影响。
点评:外界条件对盐类水解的影响,主要是依据勒夏特列原理进行判断。

练习册系列答案
相关题目
(1)水的电离平衡曲线如图所示,若A点表示25 ℃时水的电离达平衡时的离子浓度,B点表示95 ℃时水的电离达平衡时的离子浓度。则95℃时0.1 mol·L-1的NaOH溶液中,由水电离出的 c(H+)= mol·L-1,Kw(25 ℃) Kw(95℃)(填“>”、“<”或“=”)。25 ℃时,向水的电离平衡体系中加入少量NH4Cl 固体,对水的电离平衡的影响是 (填“促进”、“抑制”或“不影响”)。
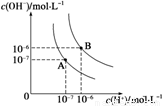
(2)25℃时,在0.1L 0.2 mol·L-1的HA溶液中,有0.001mol的HA电离成离子,则该溶液的pH= ,电离度为 。
(3)电离平衡常数是衡量弱电解质电离程度强弱的量(已知如表数据)。向NaCN溶液中通入少量CO2,所发生反应的化学方程式为 。
|
化学式 |
电离平衡常数(25 ℃) |
|
HCN |
K=4.9×10-10 |
|
H2CO3 |
K1=4.3×10-7、K2=5.6×10-11 |
 到平衡:
到平衡: PCl3(g)+C12(g) △H1>0 K1="1" mol·L-1
PCl3(g)+C12(g) △H1>0 K1="1" mol·L-1 。
。