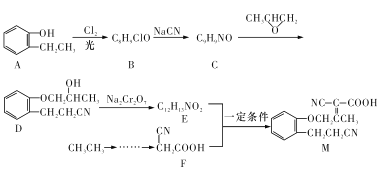
题目内容
【题目】在化学反应中,反应物转化成生成物,必然发生能量的变化.
(1)下列说法正确的是 .
A.化学反应的实质就是旧化学键的断裂,新化学键的形成,在化学反应中,反应物转化为生成物的同时,必然发生能量的变化
B.所有的放热反应都能设计成一个原电池
C.放热反应发生时不一定要加热,但吸热反应必须要加热才能发生
D.可逆反应在一定条件下有一定的限度,当反应进行到一定限度后,反应不再进行
(2)25℃、101kPa条件下,16g液态N2H4与双氧水充分反应生成氮气和气态水放出320.8kJ热量,写出热化学方程式 .
(3)101kPa条件下,氮气和氢气反应生成氨气的能量变化如图示意: 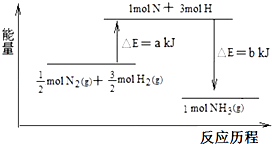 又已知:①b=1219;
又已知:①b=1219;
②25℃、101kPa下N2(g)+3H2 (g)═2NH3 (g)△H=﹣184kJmol﹣1 , 则a= .
【答案】
(1)A
(2)N2H4(l)+2H2O2(l)=N2(g)+4H2O(g);△H=﹣641.6kJ/mol
(3)1127
【解析】解:(1)A.化学反应的实质就是旧化学键的断裂,新化学键的形成,在化学反应中,反应物转化为生成物的同时,由于反应物和生成物的能量不等,必然发生能量的变化,故A正确; B.只有自发进行的氧化还原反应才能设计成原电池,所以不是任何放热反应都能设计成原电池,如酸碱中和反应,故B错误;
C.放热反应发生时不一定要加热,但吸热反应也不一定要加热,故C错误;
D.可逆反应在一定条件下有一定的限度,当反应进行到一定限度后,反应物仍然转化为生成物,故D错误;
故选:A;(2)16g液态N2H4物质的量为n(N2H4)= ![]() =
= ![]() =0.5mol,0.5mol液态N2H4与双氧水充分反应生成氮气和气态水放出320.8kJ热量,所以1mol液态肼完全反应放出641.6KJ的热量,所以热化学反应方程式为:N2H4(l)+2H2O2(l)=N2(g)+4H2O(g)△H=﹣641.6KJ/mol,所以答案是:N2H4(l)+2H2O2(l)=N2(g)+4H2O(g)△H=﹣641.6KJ/mol;(3)该反应放热,反应热=反应物的键能﹣生成物的键能,氮气和氢气反应生成氨气的热化学方程式为:
=0.5mol,0.5mol液态N2H4与双氧水充分反应生成氮气和气态水放出320.8kJ热量,所以1mol液态肼完全反应放出641.6KJ的热量,所以热化学反应方程式为:N2H4(l)+2H2O2(l)=N2(g)+4H2O(g)△H=﹣641.6KJ/mol,所以答案是:N2H4(l)+2H2O2(l)=N2(g)+4H2O(g)△H=﹣641.6KJ/mol;(3)该反应放热,反应热=反应物的键能﹣生成物的键能,氮气和氢气反应生成氨气的热化学方程式为: ![]() N2(g)+
N2(g)+ ![]() H2(gNH3(g)△H=(a﹣b)kJmol﹣1 , 则N2(g)+3H2 (g)=2NH3(g)△H=2(a﹣b)kJmol﹣1=﹣184kJmol﹣1 , 所以a﹣b=﹣92,又因b=1219,所以a﹣b=﹣92,b=1127,所以答案是:1127.
H2(gNH3(g)△H=(a﹣b)kJmol﹣1 , 则N2(g)+3H2 (g)=2NH3(g)△H=2(a﹣b)kJmol﹣1=﹣184kJmol﹣1 , 所以a﹣b=﹣92,又因b=1219,所以a﹣b=﹣92,b=1127,所以答案是:1127.
【考点精析】掌握反应热和焓变是解答本题的根本,需要知道在化学反应中放出或吸收的热量,通常叫反应热.