题目内容
【题目】第四周期的元素镓(Ga)、锗(Ge).、砷(As)、硒(Se)都在高科技尖端科学特别是信息领域有着广泛的用途。试回答下列问题:
(1)基态锗原子的价电子排布式为______________________。
(2)沸点:NH3_______AsH3(填“>”、“<”或“=”),原因是_____________________。
(3)某砷的氧化物俗称“砒霜”,其分子结构如图甲所示,该化合物的分子式为___________________,As原子采取_____________杂化。
(4)H2SeO4和H2SeO3是硒的两种含氧酸,请根据结构与性质的关系,解释H2SeO4比H2SeO3酸性强的原因________________________________________。
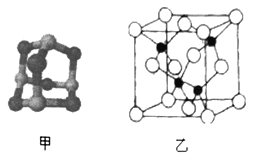
(5)砷化镓可由(CH3)2Ga和AsH3在700℃下反应制得,反应的方程式为__________________________;砷化镓的晶胞结构如图乙所示,其晶胞边长为apm,则每立方厘米该晶体中所含砷元素的质量为_____g(用NA表示阿伏加德罗常数的值)。
【答案】 4s24p2 > NH3分子间存在氢键 As4O6 sp3 H2SeO4的非羟基氧原子数多于H2SeO3中的非羟基氧原子数 (CH3)3Ga+AsH3![]() GaAs+3CH4
GaAs+3CH4 ![]()
【解析】分析: (1)锗为32号元素,根据能量最低原理书写电子排布式;(2)根据分子间能形成氢键的沸点高判断;(3)根据图中原子形成的共价键数判断属于哪种元素,再根据原子数写化学式;根据![]() 键电子对数和对孤电子对数判断As的杂化方式;(4)根据分子中化合价对电子偏向的影响分析;(5)已知反应物和部分生成物根据原子守恒书写;先求出一个晶胞中砷元素的质量,再根据晶胞的体积求算。
键电子对数和对孤电子对数判断As的杂化方式;(4)根据分子中化合价对电子偏向的影响分析;(5)已知反应物和部分生成物根据原子守恒书写;先求出一个晶胞中砷元素的质量,再根据晶胞的体积求算。
详解:(1)锗为32号元素,原子核外有32个电子,其核外价电子电子排布式为4s24p2;
因此,本题正确答案是: 4s24p2;
(2)N原子的非金属性较强,NH3分子间能形成氢键沸点高,所以NH3的沸点大于AsH3的沸点;因此,本题正确答案是: > ;NH3分子间存在氢键;
(3)氧原子能形成2个共价键,As形成3个共价键,由图可以知道分子中O原子数为6,As原子数为4,所以其化学式为As4O6;As最外层有5个电子,形成3个共价键即![]() 键电子对数为3,另外还有1个孤电子对,所以As的杂化方式为sp3;因此,本题正确答案是: As4O6 ;sp3;
键电子对数为3,另外还有1个孤电子对,所以As的杂化方式为sp3;因此,本题正确答案是: As4O6 ;sp3;
(4) H2SeO4和H2SeO3可表示为(HO)2SeO2和(HO)3Se, H2SeO4的非羟基氧原子数多于H2SeO3中的非羟基氧原子数,更易电离出H+,所以H2SeO4比H2SeO3酸性强;因此,本题正确答案是: H2SeO4的非羟基氧原子数多于H2SeO3中的非羟基氧原子数。
(5)砷化镓可由(CH3)2Ga和AsH3在700℃下反应制得,反应的方程式为: (CH3)3Ga+AsH3![]() GaAs+3CH4;由砷化镓的晶胞结构图可以知道一个晶胞中含有4个As原子,一个晶胞中砷元素的质量为
GaAs+3CH4;由砷化镓的晶胞结构图可以知道一个晶胞中含有4个As原子,一个晶胞中砷元素的质量为![]() g=
g=![]() g,晶胞的体积为
g,晶胞的体积为![]() ,则每立方厘米该晶体中所含砷元素的质量为
,则每立方厘米该晶体中所含砷元素的质量为 =
=![]() g ,因此,本题正确答案是: (CH3)3Ga+AsH3
g ,因此,本题正确答案是: (CH3)3Ga+AsH3![]() GaAs+3CH4;
GaAs+3CH4;![]() g。
g。

 作业辅导系列答案
作业辅导系列答案

