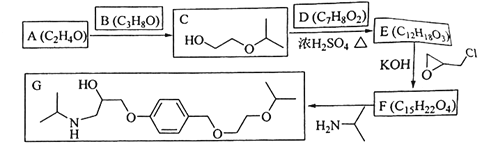
题目内容
【题目】(1)某酸性CuCl2溶液中含有少量的FeCl3,为得到纯净的CuCl22H2O晶体,加入___________________,调节pH=4过滤后,将所得滤液低温蒸发、浓缩结晶,可得到CuCl22H2O晶体。在空气中直接加热CuCl22H2O晶体得不到纯的无水CuCl2,原因是(用化学方程式表示)______________________________________________________________________ 。
(2) 由CuCl22H2O晶体得到纯的无水CuCl2的合理方法是________________________。
(3)某学习小组用“间接碘量法”测定含有CuCl22H2O晶体的试样(不含能与I―发生反应的氧化性质杂质)的纯度,过程如下:取0.36 g试样溶于水,加入过量KI固体,充分反应,生成白色沉淀。用0.1000 mol/L Na2S2O3标准溶液滴定,到达滴定终点时,消耗Na2S2O3标准溶液20.00 mL(已知:I2+2![]()
![]()
![]() +2I―)
+2I―)
①可选用___________作滴定指示剂,滴定终点的现象是_________________________ 。
②CuCl2溶液与KI反应的离子方程式为_____________________________________ 。(已知在相同条件下CuCl的溶解度大于CuI)
③该试样中CuCl22H2O的质量百分数为 __________________________________ 。
④如果试样是液体,用移液管移取时,下列使用正确的是 _____________________。

【答案】CuO或Cu(OH)2或Cu(OH)2CO3 CuCl22H2O![]() Cu(OH)Cl+HCl+H2O 在氯化氢气流中加热 淀粉 溶液由蓝色变成无色且半分钟不变色 2Cu2+ +4I-=2 CuI+I2 95.0% D
Cu(OH)Cl+HCl+H2O 在氯化氢气流中加热 淀粉 溶液由蓝色变成无色且半分钟不变色 2Cu2+ +4I-=2 CuI+I2 95.0% D
【解析】
(1)某酸性CuCl2溶液中含有少量的FeCl3,为得到纯净的CuCl22H2O晶体,加入的物质用于调节pH以除去杂质,主要将铁离子转化为氢氧化铁沉淀,且不能引入新杂质;
(2)加热时促进氯化铜的水解且生成的氯化氢易挥发造成水解完全,要想得到较纯的无水氯化铜应在氯化氢气流中加热抑制其水解;
(3)依据碘化钾和氯化铜发生氧化还原反应,生成碘化亚铜沉淀和碘单质,碘单质遇淀粉变蓝,依据碘单质被Na2S2O3标准溶液滴定到终点,根据物质间的关系式进行计算,移液管的使用方法分析判断。
(1)为得到纯净的CuCl22H2O晶体要除去氯化铁,加入的物质和氯化铁反应生成氢氧化铁且不能引进新的杂质,所以加入物质后应能转化为氯化铜,所以应该加入含铜元素的难溶化合物,可以是氧化铜或氢氧化铜或碱式碳酸铜;在空气中直接加热CuCl22H2O晶体,氯化铜水解生成碱式氯化铜,反应的化学方程式为CuCl22H2O![]() Cu(OH)Cl+HCl+H2O,故答案为:CuO;CuCl22H2O
Cu(OH)Cl+HCl+H2O,故答案为:CuO;CuCl22H2O![]() Cu(OH)Cl+HCl+H2O;
Cu(OH)Cl+HCl+H2O;
(2)由于CuCl2在加热过程中水解,水解生成的HCl挥发而脱离体系,造成水解完全,得到碱式氯化铜或氢氧化铜,而不是CuCl2,若要制得无水CuCl2,应在干燥的HCl气流中加热CuCl22H2O晶体,防止CuCl2在加热过程中水解,故答案为:在氯化氢气流中加热;
(3)①硫代硫酸钠滴定碘单质时,可利用碘单质遇淀粉变蓝选择指示剂为淀粉;终点时的现象为溶液蓝色褪去,且半分钟内不变色,故答案为:淀粉溶液;溶液蓝色褪去,且半分钟内不变色;
②CuCl2溶液与KI反应生成碘化亚铜沉淀和单质碘,反应的离子方程式为:2Cu2++4I-═2CuI↓
+I2,故答案为:2Cu2++4I-═2CuI↓+I2;
③依据反应方程式可得Na2S2O3~Cu2+,反应消耗Na2S2O3的物质的量为0.1000mol/L×0.0200L= 0.002mol,则试样中CuCl22H2O的质量百分数为![]() ×100%=95%,故答案为:95.0%;
×100%=95%,故答案为:95.0%;
④将移液管直立,锥形瓶倾斜,管下端紧靠锥形瓶内壁,放开食指,让溶液沿锥形瓶内壁流下,管内溶液流完后,保持放液状态停留15s,将移液管尖端在锥形瓶靠壁前后小距离滑动几下(或将移液管尖端靠锥形瓶内壁旋转一周),移走移液管,图示中D选项符合,故答案为:D。

 举一反三单元同步过关卷系列答案
举一反三单元同步过关卷系列答案