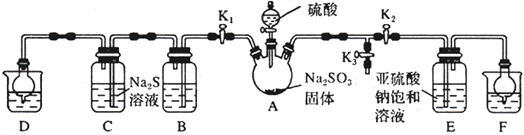
题目内容
【题目】常温下,用0.1000mol·L-1HCl溶液滴定10.00mL浓度为0.1000 mol·L-1Na2CO3溶液,所得滴定曲线如图所示。已知H2CO3的Ka1=10-6.4,Ka2=10-10.2,下列说法不正确的是

A. m=11.6
B. 当V=5时,c(Na+)>c(CO32-)>c(HCO3-)>c(OH-)>c(H+)
C. 若用酚酞作指示剂,溶液由红色变为浅红色时,消耗盐酸体积约为10mL
D. 当V=a时c(Na+)>c(Cl-)>c(H+)=c(OH-)
【答案】B
【解析】A、碳酸钠是强碱弱酸盐,能发生两步水解,第一步水解生成碳酸氢根离子和氢氧根离子,水解方程式为:CO32-+H2O![]() HCO3-+OH-,Kb=C(HCO3-)c(OH-)/c(CO32-)=kw/ka2=
HCO3-+OH-,Kb=C(HCO3-)c(OH-)/c(CO32-)=kw/ka2=![]() ,忽略二级电离,c(OH-)=10-2.4mol·L-1,pH=14-2.4=11.6,m=11.6,故A正确;B、当V=5时,溶液相当于Na2CO3 和NaHCO3的混合物,Na2CO3 的水解大于电离,故c(Na+)>c(HCO3-)>c(CO32-)>c(OH-)>c(H+),故B错误;C、若用酚酞作指示剂,溶液由红色变为浅红色时,图中第一个突变点,消耗盐酸体积约为10mL,故C正确;D、当中和到溶液恰好为碳酸氢钠时,溶液呈碱性,要变以中性还需加更多的酸,故当V=a时c(Na+)>c(Cl-)>c(H+)=c(OH-),D正确;故选B。
,忽略二级电离,c(OH-)=10-2.4mol·L-1,pH=14-2.4=11.6,m=11.6,故A正确;B、当V=5时,溶液相当于Na2CO3 和NaHCO3的混合物,Na2CO3 的水解大于电离,故c(Na+)>c(HCO3-)>c(CO32-)>c(OH-)>c(H+),故B错误;C、若用酚酞作指示剂,溶液由红色变为浅红色时,图中第一个突变点,消耗盐酸体积约为10mL,故C正确;D、当中和到溶液恰好为碳酸氢钠时,溶液呈碱性,要变以中性还需加更多的酸,故当V=a时c(Na+)>c(Cl-)>c(H+)=c(OH-),D正确;故选B。

练习册系列答案
相关题目