题目内容
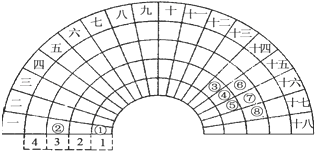
【题目】短周期常见元素形成的物质A、B、C、D、E、F的转化关系如图1所示,物质A与物质B之间的反应不在溶液中进行(E可能与A、B两种物质中的某种相同,也可能不同).请回答下列问题: 
(1)若C是一种淡黄色离子化合物,B、E为同种气体,F是一种水溶液显碱性的正盐,写出C与D反应的化学方程式
(2)若A、B反应生成C是人工工业固氮的反应原理,D是双原子分子气态单质,其密度为3.17g/L(标准标况下),F在常温下是一种无色晶体,且受热易分解,写出实验室检验无机盐F中阳离子的方法: .
(3)若C是一种气体,D在常温下是一种无色无味的液体,E为无色气体,F是一种强酸.
①C与D反应的化学方程式 .
②有人认为“浓H2SO4可以干燥气体C”.甲同学为了验证该观点是否正确,用图2装置进行实验.实验过程中,在小铜块和浓硝酸刚开始反应的一段时间内浓H2SO4中未发现有气体逸出,且浓硫酸颜色加深,则你得出的结论是 .
③甲同学设计的实验中,装置Ⅲ的主要作用 .
④甲同学在实验过程中装置Ⅲ内发生一氧化还原反应生成两种钠盐,其中一种是外观与食盐很相似的有毒物质亚硝酸盐,写出该反应的方程式
【答案】
(1)2Na2O2+2CO2=2Na2CO3+O2
(2)取待测样品少许置于试管中,加氢氧化钠溶液,加热,将湿润的红色石蕊试纸置于试管口,若试纸变蓝,则待测样品含铵根离子
(3)3NO2+H2O=2HNO3+NO;NO2能溶于浓H2SO4 , 因而不能用浓H2SO4干燥NO2;吸收尾气(NO2),防止污染空气;2NO2+2NaOH=NaNO2+NaNO3+H2O
【解析】解:(1)若C是一种淡黄色离子化合物判定为Na2O2 , B、E为同种气体为氧气,则A为Na,过氧化钠和D反应得到F是一种水溶液显碱性的正盐,判断F为Na2CO3 , D为CO2 , C与D反应的化学方程式为:2Na2O2+2CO2=2Na2CO3+O2 ,
所以答案是:2Na2O2+2CO2=2Na2CO3+O2;
(2.)若A、B反应生成C是人工工业固氮的反应原理,判断为是氨气和氢气合成氨的反应,生成化合物C为NH3 , D是双原子分子气态单质,其密度为3.17g/L(标准标况下),则D的摩尔质量=3.17g/L×22.4L/mol=71g/mol,得到D为Cl2 , F在常温下是一种无色晶体,且受热易分解,结合转化关系判断为NH4Cl,实验室检验无机盐F中阳离子是检验铵根离子的存在,设计实验为:取待测样品少许置于试管中,加氢氧化钠溶液,加热,将湿润的红色石蕊试纸置于试管口,若试纸变蓝,则待测样品含铵根离子,
所以答案是:取待测样品少许置于试管中,加氢氧化钠溶液,加热,将湿润的红色石蕊试纸置于试管口,若试纸变蓝,则待测样品含铵根离子;
(3.)若C是一种气体,D在常温下是一种无色无味的液体,E为无色气体,F是一种强酸,推断C为NO2 , D为H2O,F为HNO3 , E为NO,
①C与D反应是二氧化氮和水反应生成硝酸和一氧化氮,反应的化学方程式3NO2+H2O=2HNO3+NO,
所以答案是:3NO2+H2O=2HNO3+NO;
②由现象实验过程中,浓H2SO4中未发现有气体逸出,可以得出NO2能溶于浓硫酸中,
所以答案是:NO2能溶于浓H2SO4 , 因而不能用浓H2SO4干燥NO2;
③甲同学设计的实验中,装置Ⅲ的主要作用是:吸收尾气(NO2),防止污染空气,
所以答案是:吸收尾气(NO2),防止污染空气;
④甲同学在实验过程中装置Ⅲ内发生一氧化还原反应生成两种钠盐,其中一种是外观与食盐很相似的有毒物质亚硝酸盐,是二氧化氮和氢氧化钠溶液反应生成亚硝酸钠、硝酸钠和水,反应的化学方程式为:2NO2+2NaOH=NaNO2+NaNO3+H2O,
所以答案是:2NO2+2NaOH=NaNO2+NaNO3+H2O.

 字词句篇与同步作文达标系列答案
字词句篇与同步作文达标系列答案【题目】生产中可用双氧水氧化法处理电镀含氰废水,某化学兴趣小组模拟该法探究有关因素对破氰反应速率的影响(注:破氰反应是指氧化剂将CN﹣氧化的反应).
【相关资料】
①氰化物主要是以CN﹣和[Fe(CN)6]3﹣两种形式存在.
②Cu2+可作为双氧水氧化法破氰处理过程中的催化剂;Cu2+在偏碱性条件下对双氧水分解影响较弱,可以忽略不计.
③[Fe(CN)6]3﹣较CN﹣难被双氧水氧化,且pH越大,[Fe(CN)6]3﹣越稳定,越难被氧化.
【实验过程】
在常温下,控制含氰废水样品中总氰的初始浓度和催化剂Cu2+的浓度相同,调节含氰废水样品不同的初始pH和一定浓度双氧水溶液的用量,设计如下对比实验:
(1)请完成以下实验设计表(表中不要留空格)
实验 | 实验目的 | 初始pH | 废水样品体积/mL | CuSO4溶液的体积/mL | 双氧水溶液的体积/mL | 蒸馏水的体积/mL |
① | 为以下实验操作参考 | 7 | 60 | 10 | 10 | 20 |
② | 废水的初始pH对破氰反应速率的影响 | 12 | 60 | 10 | 10 | 20 |
③ | 7 | 60 | 10 |
(2)实验测得含氰废水中的总氰浓度(以CN﹣表示)随时间变化关系如图所示.
实验①中20~60min时间段反应速率:υ(CN﹣)= molL﹣1min﹣1 .
(3)实验①和实验②结果表明,含氰废水的初始pH增大,破氰反应速率减小,其原因可能是 (填一点即可).在偏碱性条件下,含氰废水中的CN﹣最终被双氧水氧化为HCO3﹣ , 同时放出NH3 , 试写出该反应的离子方程式: .
(4)该兴趣小组同学要探究Cu2+是否对双氧水氧化法破氰反应起催化作用,请你帮助他设计实验并验证上述结论,完成下表中内容.(己知:废水中的CN﹣浓度可用离子色谱仪测定)
实验步骤(不要写出具体操作过程) | 预期实验现象和结论 |