题目内容
【题目】以菱锰矿(主要成分![]() 还含有
还含有![]()
![]() 等杂质)为原料制各二氧化锰的工艺流程如下:
等杂质)为原料制各二氧化锰的工艺流程如下:
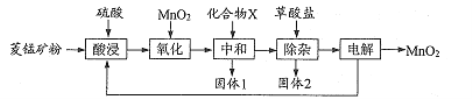
已知草酸钙、草酸镁不溶于水。
(1)写出“氧化”时发生反应的离子方程式:____。
(2)“中和”的目的是将铁、铝元素转化为沉淀除去,化合物X可用 ____(写一种物质的化学式)。
(3)该工艺流程中固体l和固体2均需用水洗涤,目的是________。
(4)“除杂”时,除去的金属离子有___。
(5)“电解”原理如下图所示,阳极的电极反应式为___
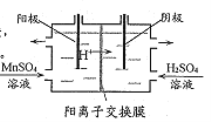
(6)该流程中可以循环使用的物质有 ___ 。
【答案】 MnO2+2Fe2++4H+===Mn2+ +2Fe3++2H2O CaCO3(或MnCO3等合理) 用水洗涤滤渣,洗出液用于酸浸工序,提高锰的回收率(或用水洗涤滤渣,洗出液循环利用,提高锰的回收率等合理) Ca2+、Mg2+ Mn2++2H2O–2e-=== MnO2+4H+ H2SO4、MnO2
【解析】(1)酸浸后溶液中含有亚铁离子,能被二氧化锰氧化,则“氧化”时发生反应的离子方程式为MnO2+2Fe2++4H+=Mn2++2Fe3++2H2O。(2)“中和”的目的是将铁、铝元素转化为沉淀除去,由于不能再引入新杂质,则化合物X可用MnCO3。(3)过滤得到的沉淀表面含有杂质离子,因此该工艺流程中固体l和固体2均需用水洗涤滤渣,洗出液用于酸浸工序,提高锰的回收率。(4)已知草酸钙、草酸镁不溶于水,则“除杂”时,除去的金属离子有Ca2+、Mg2+。(5)阳极锰离子失去电子转化为二氧化锰,则阳极的电极反应式为Mn2++2H2O–2e-=MnO2+4H+。(6)硫酸锰电解生成二氧化锰和硫酸,则该流程中可以循环使用的物质有H2SO4、MnO2。

练习册系列答案
相关题目