题目内容
【题目】某研究性学习小组为测定某含镁3%~5%的铝镁合金(不含其他元素)中镁的质量分数,设计了下列两种不同实验方案进行探究,请根据他们的设计回答有关问题。
[探究一]实验方案:铝镁合金![]() 测定剩余固体质量。
测定剩余固体质量。
问题讨论:
(1)实验中发生反应的化学方程式是___________________。
(2)若实验中称取5.4 g铝镁合金粉末样品,投入V mL 2.0 mol/L NaOH溶液中,充分反应。则NaOH溶液的体积V≥________ mL。
(3)实验中,当铝镁合金充分反应后,在称量剩余固体质量前,还需进行的实验操作按顺序依次为_________________________________________。
[探究二]实验方案:称量x g的铝镁合金粉末,放在如图所示装置的惰性电热板上,通电使其充分灼烧。
问题讨论:
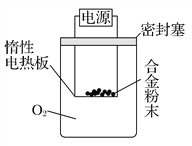
(4)欲计算Mg的质量分数,该实验中还需测定的数据_____________________。
(5)假设实验中测出该数据为y g,则原铝镁合金粉末中镁的质量分数为________(用含x、y的代数式表示)。
【答案】 2Al+2NaOH+2H2O===2NaAlO2+3H2↑ 97 过滤、洗涤、干燥固体 灼烧后固体的质量 ![]()
【解析】(1)铝与氢氧化钠溶液反应生成偏铝酸钠与氢气,反应方程式为2Al+2NaOH+2H2O=2NaAlO2+3H2↑;
(2)含镁为3%时,金属铝的含量最高,5.4g合金中铝的质量为,5.4g×(1-3%)=5.4×97%g,则:
2Al+2NaOH+2H2O=2NaAlO2+3H2↑
54g 2mol
5.4g×97% V×10-3L×2.0mol/L
54g:(5.4g×97%)=2mol:(V×10-3L×2.0mol/L),解得:V=97,故V(NaOH溶液)≥97mL;
(3)反应后金属铝完全消耗,没有反应的为金属镁,称量金属镁之前需要经过过滤、洗涤、干燥操作,然后再称量固体质量,从而计算出合金中镁的含量;
(4)Mg、Al均与氧气反应,生成金属氧化物,则还需测定生成物的质量;
(5)设xg铝镁合金粉末中含有n mol镁、zmol铝,则24n+27z=x①,再根据反应关系式:Mg~MgO、Al~Al2O3,最后得到了yg氧化物,据此列式为:40n+51z=y②,根据①②解得:z=(3y5x)/18mol,铝的质量为:27g/mol×(3y5x)/18mol=(9y15x)/2g,合金中镁的质量分数为![]() 。
。

 一课一练课时达标系列答案
一课一练课时达标系列答案 期末宝典单元检测分类复习卷系列答案
期末宝典单元检测分类复习卷系列答案